Štruktúra hypochlórnej kyseliny (HCLO), vlastnosti, použitia, syntéza
- 4623
- 966
- Václav Višňovský
On Kyselina Je to anorganická zlúčenina, ktorej chemický vzorec je HCLO. Zodpovedá aspoň hrdzavým chlórovým oxoacidám, pretože obsahuje iba jeden atóm kyslíka. Od neho odvodzujte hypochlórát anión, clo-, a jeho soli, široko používané ako komerčné dezinfekčné prostriedky na vodu.
HCLO je najsilnejšie oxidačné a antimikrobiálne činidlo, ako sa vytvára, keď sa plynný chlór rozpustí vo vode. Jeho antiseptický účinok je známy viac ako storočie, ešte predtým, ako sa na čistenie rán vojakov v prvej svetovej vojne použili roztoky chlóru.
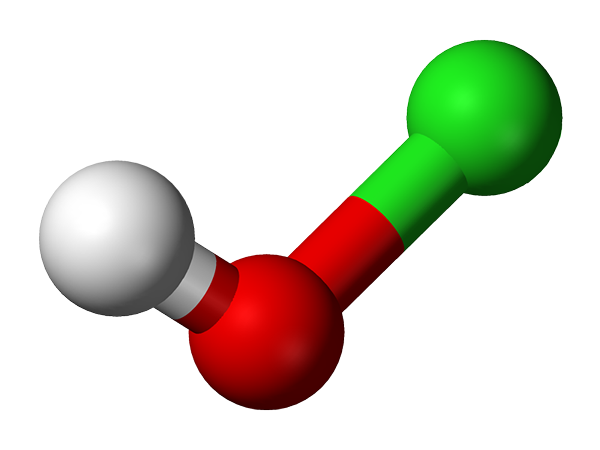
 Molekula hypopokloróznej kyseliny predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Ben Mills a Jynto [verejná doména]
Molekula hypopokloróznej kyseliny predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Ben Mills a Jynto [verejná doména] Jeho de facto objav siaha až do roku 1834 francúzsky chemik Antoine Jérôme Balard, ktorý dosiahol čiastočnú oxidáciu chlóru, ktorý ho bubol vo vodnom suspenzii oxidu ortuti, HGO. Odvtedy sa používa ako dezinfekčný a antivírusový činiteľ.
Chemicky, HCLO je oxidačné činidlo, ktoré nakoniec dáva svoj atóm chlóru iným molekulám; To znamená, že s ním môžu byť syntetizácie chlórované zlúčeniny, ktoré sú chlóramíny s veľkým významom pri vývoji nových antibiotík.
V 70. rokoch sa zistilo, že telo je schopné prirodzene produkovať túto kyselinu pôsobením enzýmu myeloperoxidázy; Enzým pôsobiaci na peroxidy a anióny chloridu počas fagocytózy. Z toho istého organizmu teda môže vzniknúť tento „vrah“ votrelcov, ale v neškodnej mierke pre svoju vlastnú studňu.
[TOC]
Štruktúra
Štruktúra HCLO sa zobrazuje na hornom obrázku. Všimnite si, že vzorec je v rozpore s štruktúrou: molekula je H-O-Cl a nie H-Cl-O; Tento však zvyčajne uprednostňuje, aby bol schopný ich porovnávať priamo so svojimi najviac oxidovanými náprotivkami: HCLO2, HCLO3 A HCLO4.
 Chemická štruktúra hypochlórnej kyseliny.
Chemická štruktúra hypochlórnej kyseliny. Kyslý vodík, h+, Vydané HCLO sa nachádza v skupine OH spojenej s atómom chlóru. Všimnite si pozoruhodné rozdiely v dĺžke v O-H a CL-O spojeniach, ktoré sú najdlhšie v dôsledku nižšieho stupňa prekrývania sa orbitálov chlóru, difúznejšie, s tými kyslíkom.
Molekula Hocl môže sotva zostať stabilná za normálnych podmienok; Nemôže byť izolovaný z jeho vodných roztokov bez rozlíšenia alebo uvoľňovania ako plynný chlór CL2.
Preto neexistujú žiadne bezvodé kryštály (ani ich hydráty) hypochlórnej kyseliny; A doteraz neexistujú žiadne náznaky, že ich môžu pripraviť extravagantnými metódami. Ak sa má kryštalizovať, molekuly HCLO by navzájom interagovali prostredníctvom svojich trvalých dipólov (orientované negatívne zaťaženia smerom k kyslíku).
Môže vám slúžiť: cyklohexen: štruktúra, vlastnosti, syntéza a použitiaVlastnosti
Kyslosť
HCLO je kyselina monoprotická; To znamená, že môžete darovať iba H+ do vodného prostredia (ktoré je tam, kde sa vytvára):
HCLO (AC) + H2Alebo ↔ clo-(Ac) + h3Ani+(Ac) (PKA = 7,53)
Z tejto rovnovážnej rovnice sa pozoruje, že zníženie H iónov3Ani+ (Zvýšenie základnosti životného prostredia), uprednostňuje tvorbu viacerých aniónov chlóru, CLO-. V dôsledku toho, ak si chcete udržiavať roztok CLO relatívne stabilné- Je potrebné, aby pH bolo základné, čo sa dosahuje s NaOH.
Jeho disociačná konštanta, PKA, si je vedomá, že HCLO je slabá kyselina. Preto pri manipulácii s jeho koncentrovanou by sme sa nemali obávať o H ióny3Ani+, ale samotným HCLO (vzhľadom na jeho vysokú reaktivitu a nie jej korozivitou).
Oxidačný činiteľ
Bolo spomenuté, že atóm chlóru v HCLO má oxidačné číslo +1. To znamená, že sotva vyžaduje zisk jedného elektrónu, aby sa vrátil do svojho bazálneho stavu (CL0) a byť schopný tvoriť molekulu CL2. V dôsledku toho sa HCLO zníži na CL2 a h2Alebo rýchlejšia oxidácia iného druhu v porovnaní s rovnakým CL2 alebo clo-:
2hclo (ac) + 2h+ + 2e- ↔ cl2g) + 2h2Alebo (l)
Táto reakcia vám umožňuje nahliadnuť do toho, ako stabilný HCLO vo svojich vodných roztokoch.
Jeho oxidačná sila sa nielen meria tvorbou CL2, ale tiež pre svoju schopnosť vzdať sa svojho atómu chlóru. Napríklad môžete reagovať s dusíkovými druhmi (vrátane amoniaku a dusíkových báz), aby ste spôsobili chlóamíny:
HCLO + N-H → N-CL + H2Ani
Všimnite si, že N-H odkaz, aminoskupina (-NH je zlomená (-nh2) väčšinou a je nahradený jedným n-cl. To isté platí pre O-H väzby hydroxylových skupín:
HCLO + O-H → O-CL + H2Ani
Tieto reakcie sú rozhodujúce a vysvetľujú dezinfekčný a antibakteriálny účinok HCLO.
Stabilita
HCLO je nestabilný takmer tam, kde vyzerá. Napríklad anión hypochlóru je pri druhoch chlóru neprimeraný s oxidačným počtom -1 a +5, stabilnejší ako +1 v HCLO (H+Cl+Ani2-):
3Cl-(Ac) ↔ 2cl-(ac) + clo3-(Ac)
Táto reakcia by posunula rovnováhu smerom k zmiznutiu HCLO. HCLO sa tiež zúčastňuje priamo na paralelnej rovnováhe s plynným vodou a chlórom:
Môže vám slúžiť: fúziaCl2g) + h2Alebo (l) ↔ hclo (ac) + h+(Ac) + cl-(Ac)
Preto pokus o zahriatie roztoku HCLO na jeho koncentráciu (alebo ho izolovať) vedie k výrobe CL2, čo je identifikované tým, že je žltý plyn. Podobne tieto roztoky nemôžu byť príliš dlho vystavené svetlu alebo prítomnosti oxidov kovu, keď rozkladajú CL2 (HCLO zmizne ešte viac):
2cl2 + 2h2O → 4hcl + o2
HCL reaguje s HCLLO, aby generoval viac CL2:
HCLO + HCI → CL2 + H2Ani
A tak ďalej, kým nie je viac HCLO.
Syntéza
Voda
Jedna z metód na prípravu alebo syntetizáciu kyseliny hypochlórnej kyseliny už bola implicitne vysvetlená: rozpustenie plynného chlóru vo vode. Ďalšou pomerne podobnou metódou je rozpustenie vo vode anhydrid tejto kyseliny: dichlórovooxid, CL2Buď:
Cl2Alebo (g) + h2Alebo (l) ↔ 2hclo (ac)
Opäť neexistuje spôsob, ako izolovať čisté HCLO, pretože odparuje vodu, ktorá by vytlačila rovnováhu k tvorbe CL2Alebo plyn, ktorý by unikol z vody.
Na druhej strane bolo možné pripraviť koncentrovanejšie roztoky HCLO (20%) pomocou oxidu ortuti, HGO. Chlór sa rozpustí v objeme vody práve v bode mrazu, takže sa získa chlórovaný ľad. Potom sa ten istý ľad mieša a pri topení je zmiešaný s HGO:
2cl2 + HGO + 12H2O → 2HCLO + HGCL2 + 11h2Ani
20% HCLO rozpustenie môže byť konečne destilované vo vákuu.
Elektrolýza
Jednoduchšia a bezpečnejšia metóda na prípravu roztokov hypochlórnych kyselín je použitie salmuelov ako suroviny namiesto chlóru. Salmueras sú bohaté na anióny chloridov, CL-, ktorý prostredníctvom procesu elektrolýzy môže oxidovať2:
2h2O → o2 + 4H+ + 4e-
2cl- ↔ 2e- + Cl2
Tieto dve reakcie sa vyskytujú v anóde, kde sa vyrába chlór, ktorý sa okamžite rozpustí, aby vznikol HCLO; Zatiaľ čo v katódovom priehradke sa zníži voda:
2h2O + 2e- → 2OH- + H2
Týmto spôsobom je možné syntetizovať HCLO v komerčnom až priemyselnom meradle; A tieto roztoky získané zo Salmueras sú v skutočnosti výrobky dostupné na trhu tejto kyseliny.
Žiadosti
Všeobecné vlastnosti
HCLO sa môže použiť ako oxidačné činidlo na oxidáciu alkoholov na ketóny a na syntézu chloramínov, chloramidov alebo hydrochlorínov (od alkénov).
Všetky jeho ďalšie použitia však možno zahrnúť slovom: Biocida. Je to huba, baktérie, vírusy a toxíny uvoľňované patogénmi.
Môže vám slúžiť: kyselina maleico: Štruktúra, vlastnosti, získanie, použitieImunitný systém nášho tela syntetizuje svoj vlastný HCLO pôsobením enzýmu myeloperoxidázy a pomáha bielym krvinkám eradikovať votrelcov, ktorí spôsobujú infekciu.
Infinity v štúdiách navrhujú rôzne mechanizmy pôsobenia HCLO na biologickú maticu. To daruje jeho atóm chlóru aminoskupinám určitých proteínov a tiež oxiduje ich skupiny SH prítomné na disulfidy S-S, čo je ich denaturácia.
Zastavuje tiež replikáciu DNA reakciou s dusíkovými bázami, ovplyvňuje úplnú oxidáciu glukózy a môže tiež deformovať bunkovú membránu. Všetky tieto akcie nakoniec spôsobujú, že smrť zárodkom.
Dezinfekcia a čistenie
Preto sa riešenia HCLO nakoniec použijú pre:
-Liečba infekčných a rany Gangrenas
-Dezinfikovať zásoby vody
-Sterilizačné činidlo chirurgického materiálu alebo nástrojov používaných vo veterinárnej, medicíne a stomatológii
-Dezinfekčný prostriedok akéhokoľvek typu povrchu alebo predmetu všeobecne: bary, zábradlia, kávovary, keramika, sklenené stoly, laboratórne hostince atď.
-Syntetizovať chloroamíny, ktoré slúžia ako menej agresívne antibiotiká, ale zároveň odolnejšie, špecifickejšie a stabilnejšie ako samotný HCLO
Riziká
Roztoky HCLO môžu byť nebezpečné, ak sú veľmi koncentrované, pretože môžu násilne reagovať s druhmi, ktoré pravdepodobne oxidujú. Okrem toho majú tendenciu uvoľňovať plynný chlór destabilizáciou, takže musia byť uložené pod prísnym bezpečnostným protokolom.
HCLO je tak reaktívny voči baktériám, že tam, kde je zavlažované, zmizne v konaní, bez toho, aby predstavoval riziko pre tých, ktorí sa dotýkajú povrchov, ktoré s ním liečili. To isté sa deje vo vnútri organizmu: rýchlo sa rozkladá alebo je neutralizovaný akýmkoľvek druhom biologického prostredia.
Keď samotný organizmus vytvára, predpokladá sa, že to môže tolerovať nízke koncentrácie HCLO. Ak je však veľmi koncentrovaný (používa sa na syntetické a ne -disinktantné účely), môže to viesť k nežiaducim účinkom útočením na zdravé bunky (napríklad pokožka).
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Gottardi, w., DeBabov, D., & Nagl, m. (2013). N-chloramíny, sľubná trieda dobre vybavených topických antiinfekčných látok. Antimikrobiálne látky a chemoterapia, 57 (3), 1107-1114. Doi: 10.1128/AAC.02132-12
- Autor: Jeffrey Williams, Eric Rasmussen a Lori Robins. (6. októbra 2017). Hypochlorousová kyselina: Využívanie vrodenej reakcie. Získané z: infekcie.Tipy
- Hydro nástroje. (s.F.). Základná chémia chlorácie. Zdroj: Hydroinstrunts.com
- Wikipedia. (2019). Kyselina. Zdroj: In.Wikipedia.orgán
- Serhan Sakarya a kol. (2014). Hypochlorousová kyselina: Ideálne činidlo starostlivosti o rany s silným mikrobicídom, antibiofilmom a hojením rany. Rany HMP. Získané z: RoundsResearch.com
- Prebchem. (2016). Príprava kyseliny hypochlórnej. Získané z: Prepchem.com
- « 15 výhod jabĺk pre fyzické a duševné zdravie
- Zemský magnetický poľný pôvod, charakteristiky, funkcia »

