Kyselina mravčená (HCOOH)
- 3861
- 1175
- JUDr. Rudolf Čapkovič
Vysvetlíme, čo je kyselina mravčová, jej vlastnosti, štruktúra a aplikácie
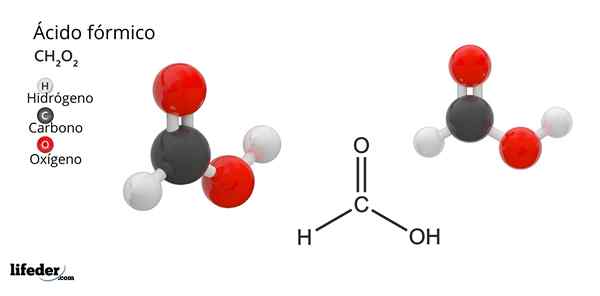
 Vzorec a štruktúra kyseliny mravčej
Vzorec a štruktúra kyseliny mravčej Čo je kyselina mravčová?
On kyselina alebo kyselina metánJe to najjednoduchšia a malá zlúčenina všetkých organických kyselín. Je tiež známa ako kyselina metán a jej molekulárny vzorec je HCOOH, má iba atóm vodíka spojeného s atómom uhlíka. Jeho meno je odvodené zo slova formica, čo v latinčine znamená mravec.
Prírodovedci pätnásteho storočia zistili, že určité typy hmyzu (formícidos), ako sú mravce, termity, včely a chrobáky, vylučujú túto zlúčeninu zodpovednú za ich bolestivé nasekané nasekané. Tento hmyz tiež používa kyselinu mravčú ako mechanizmus na útok, obranu a chemické značenie.
Majú jedovaté žľazy, ktoré vylučujú toto a iné kyseliny (napríklad kyselina octová), ako je napríklad rosa vonku. Kyselina mravčej je silnejšia ako kyselina octová (CH3Cooh); Preto, rozpustená v rovnakých množstvách vo vode, kyselina mravčová produkuje roztoky s nižšími hodnotami pH.
Anglický prírodovedec John Ray dosiahol izoláciu kyseliny mravčej v roku 1671, pričom ju rozlíšil z veľkého množstva mravcov.
Na druhej strane, prvú úspešnú syntézu tejto zlúčeniny vykonal francúzsky chemik a fyzik Joseph Gay-Lussac, s použitím nočnej kyseliny (HCN) ako činidla.
Kde je kyselina mravčová?
 Mravce vylučujú kyselinu mravčú
Mravce vylučujú kyselinu mravčú Kyselina mravčená môže byť prítomná na suchozemských hladinách ako zložka biomasy alebo v atmosfére, ktorá sa podieľa na širokom spektre chemických reakcií; Dalo sa dokonca nájsť pod pôdami, vo vnútri oleja alebo v plynnej fáze na jej povrchu.
Pokiaľ ide o biomasu, hmyz a rastliny sú hlavnými generátormi tejto kyseliny. Keď sa spaľujú fosílne palivá, produkujú kyselinu plynnú mravčú; Následne vozidlá uvoľňujú kyselinu mravčú do atmosféry.
Zem je však hostiteľom prehnaného počtu mravcov a medzi všetkými sú schopné vyrábať za rok tisíckrát množstvo kyseliny mravčej generovanej ľudským priemyslom. Forest Fires tiež predstavujú plynné zdroje kyseliny mravčej.
Môže vám slúžiť: lítium: História, štruktúra, vlastnosti, riziká a použitieV komplexnej atmosférickej matrici sa vyskytujú fotochemické procesy, ktoré syntetizujú kyselinu mravčú.
V tomto bode sa mnoho prchavých organických zlúčenín (VOC) degraduje pod vplyvom ultrafialového žiarenia alebo sa oxiduje mechanizmami voľných radikálov OH. Bohatá a komplexná atmosférická chémia je zďaleka prevládajúcim zdrojom formálnej kyseliny mravčej.
Štruktúra kyseliny mravčej
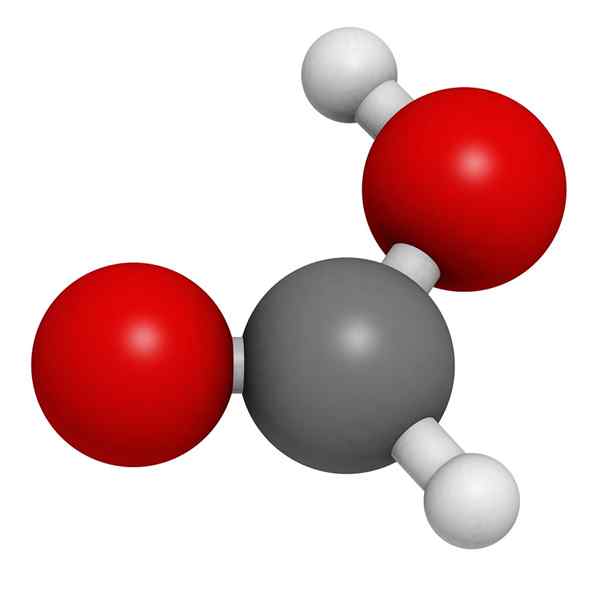 Molekulárny model kyseliny mravčej
Molekulárny model kyseliny mravčej Na vynikajúcom obraze je ilustrovaná štruktúra plynnej fázy kyseliny mravčej. Biele gule zodpovedajú atómom vodíka, atómom červeného kyslíka a čiernych atómov.
V týchto molekulách je možné oceniť dve skupiny: hydroxyl (-OH) a formil (-ch = o), ktoré sú schopné tvoriť vodíkové mosty.
Tieto interakcie sú typu O-H-O, pretože sú skupinami Hydroxils Darcovia H a skupiny formujú darcovia OR.
Avšak H spojené s atómom uhlíka chýba táto kapacita. Tieto interakcie sú veľmi silné a kvôli atómu H chudobných v elektronoch je vodík zo skupiny OH kyslejší; Preto tento vodík ďalej stabilizuje mosty.
V dôsledku vyššie uvedeného kyseliny mravčej existuje vo forme skrutky a nie ako individuálna molekula.
Kryštalická štruktúra
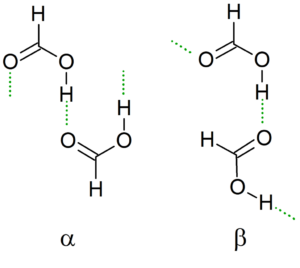
Keď teplota zostupuje, dimér vedie svoje vodíkové mostíky, aby vytvorili najstabilnejšiu možnú štruktúru spolu s ostatnými dimérmi, čím sa vytvára nekonečné reťazce a a p kyseliny mravčej.
Ďalšou nomenklatúrou sú konforméry „cis“ a „trans“. V tomto prípade sa „cis“ používa na označenie skupín orientovaných rovnakým smerom a „trans“ pre tieto skupiny naopak.
Môže vám slúžiť: Tanteo Balance: Kroky, príklady a cvičeniaNapríklad v reťazci a formilné skupiny „bod“ na tú istú stranu (vľavo), na rozdiel od β reťazca, kde tieto fortylové skupiny poukazujú na opačné strany (vynikajúci obraz).
Táto kryštalická štruktúra závisí od fyzikálnych premenných, ktoré na ňu pôsobia, ako je tlak a teplota. Reťaze sú teda konvertibilné; To znamená, že za rôznych podmienok je možné reťazec „cis“ transformovať na reťazec „trans“ a naopak.
Ak sa tlaky zvyšujú na drastické hladiny, reťazce sú dostatočne stlačené na to, aby sa považovali za kryštalický polymér kyseliny mravčej.
Vlastnosti kyseliny mravčej
Fyzikálne a chemické vlastnosti kyseliny mravčej sú uvedené nižšie:
- Kyselina formová je kvapalina pri izbovej teplote, bezfarebná a so silnou a prenikajúcou vôňou. Má molekulovú hmotnosť 46 g/mol, topí sa na 8,4 ° C a má bod varu 100,8 ° C, väčší ako voda.
- Je miešateľný vo vode a polárnych organických rozpúšťadlách, ako je éter, acetón, metanol a etanol.
- Na druhej strane, v aromatických rozpúšťadlách (ako je benzén a toluén) je mierne rozpustný, pretože kyselina mravčová má sotva atóm uhlíka vo svojej štruktúre.
- Má PKA 3,77, viac kyseliny ako kyselina octová, čo možno vysvetliť, pretože metylová skupina poskytuje elektronickú hustotu oxidovaného atómu uhlíka dvoma kyslíkom. To má za následok mierny zostup v kyslosti protónu (ch3Cooh, Hcooh).
- Nepochybné kyselina sa to stáva formátom aniónu HCOO-, ktoré môžu demociť negatívnu záťaž medzi dvoma atómami kyslíka. Preto je to stabilný anión a vysvetľuje veľkú kyslosť kyseliny mravčej.
Reakcie
Kyselina mravčej sa môže dehydratovať v oxidu uhoľnatého (CO) a vodou. V prítomnosti katalyzátorov platiny sa môže tiež rozkladať v molekulárnom vodíku a oxidu uhličitého:
HCOOH (L) → H2g) + Co2g)
Táto vlastnosť umožňuje, aby sa kyselina mravčová považovala za bezpečný spôsob skladovania vodíka.
Použitie/aplikácie kyseliny mravčej
Priemysel potravín a poľnohospodárstva
Napriek tomu, ako môže byť škodlivá kyselina mravčová, používa sa pri adekvátnych koncentráciách ako konzervačný prostriedok v potravinách kvôli jej antibakteriálnemu pôsobeniu. Z toho istého dôvodu sa používa v poľnohospodárstve, kde má tiež akciu pesticídov.
Predstavuje tiež konzervačné pôsobenie na pastviny, čo pomáha predchádzať črevným plynom u chovných zvierat.
Odvetvie textilu a obuvi
Používa sa v textilnom priemysle pri farbení a vylepšení textilu, pravdepodobne najčastejším použitím tejto kyseliny je.
Kyselina mravčej sa používa pri spracovaní kože kvôli jej úbohému pôsobeniu a pri odstraňovaní vlasov tohto materiálu.
Bezpečnosť na cestách na cestách
Okrem uvedeného priemyselného použitia sa tí, ktorí sú odvodené z kyseliny vo formáte (formáty), používajú vo Švajčiarsku a Rakúsku na cestách počas zimy, aby sa znížilo riziko nehôd. Toto ošetrenie je účinnejšie ako použitie bežnej soli.
Odkazy
- Tellus (1988). Atmosférická forma z mravcov Formicine: A predbežné hodnotenie408, 335-339.
- B. Proso a kol. (2015). Zdroje a umývadlá kyseliny atmosférickej mravčej. Atmos. Chem. Fyzický., 15, 6283-6304.
- Wikipedia. (2018). Kyselina. Získaný z.Wikipedia.orgán
- Aktívny. Kyselina. Zotavené z Actipedia.orgán
- DR. N. Klimatizovať. Patel. Modure: 2, prednáška: 7. Kyselina. NPTEL sa obnovil.Ac.v
- Jean a Fred. (14. júna 2017). Opúšťanie kopcov termitov. [Obrázok]. Získané z: Flickr.com

