Chemická štruktúra kyseliny boritá, vlastnosti, príprava, použitie

- 1556
- 153
- Mgr. Pravoslav Mokroš
On kyselina boritá Je to anorganická zlúčenina, ktorej chemický vzorec je H3Bož3. Pozostáva z bielej alebo bezfarebnej pevnej látky. Je to slabá kyselina, ktorá vo vodnom roztoku produkuje v závislosti od jej koncentrácie pH medzi 3,8 a 4,8. Je málo rozpustný v chladnej a mierne rozpustnej horúcej vode.
Kyselinu boritá objavila v roku 1702 Wilhelm Man.
 Tuhá vzorka kyseliny boritej na hodinovom skle. Zdroj: Walkerma cez Wikipedia.
Tuhá vzorka kyseliny boritej na hodinovom skle. Zdroj: Walkerma cez Wikipedia. Je však tiež zdôraznené, že Boerg pripravil kyselinu boricu pridaním vody do boraxu a zahrieva roztok, aby sa odparil, a tak v sedimente kryštály kryšlo.
Táto kyselina je veľmi užitočná zlúčenina, ktorá má početné aplikácie v priemysle a medicíne, ktorá sa tiež používa ako insekticíd, zachovanie dreva, spomaľuje požiar a je zložkou roztoku tlmenia pH tlmenia pH.
[TOC]
Chemická štruktúra
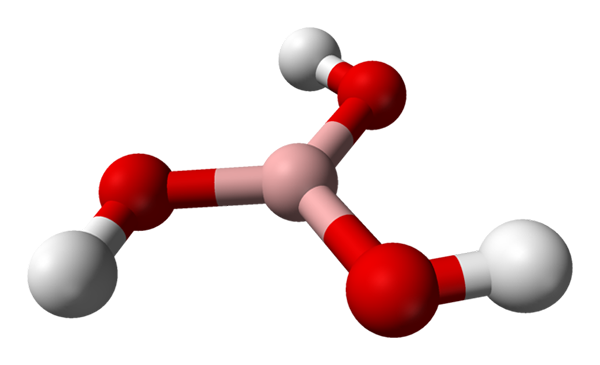 Molekula kyseliny boritá predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Benjah-Bmm27 [verejná doména]
Molekula kyseliny boritá predstavovaná s guľovými a stĺpcovými modelmi. Zdroj: Benjah-Bmm27 [verejná doména] Na vynikajúci obraz máme samotnú molekulu H3Bož3. Všimnite si, že atómy vodíka, reprezentované bielymi guľami, nie sú spojené s atómom centrálneho bóru, ako by to mohlo naznačovať chemický vzorec; ale skôr na atómy kyslíka, ktoré predstavujú červené gule.
Pohodlnejší vzorec, aj keď menej používa, pre kyselinu boritá je B (OH)3, čo naznačuje, že ich kyslosť je spôsobená H iónmi+ Oslobodené od ich OH skupín. Molecula B (OH)3 Má trigonálnu plochú geometriu, pričom jeho atóm bóru má chemickú hybridizáciu SP2.
B (oh)3 Je to kovalentná vysoká molekula, pretože rozdiel v elektronegativite medzi atómom bóru a kyslíkom nie je príliš veľký; Takže odkazy B-O sú v podstate kovalentné. Všimnite si, že štruktúra tejto molekuly pripomína štruktúru rozmetávač. Môžem rovnakým spôsobom zapnúť svoju vlastnú os?
Kryštály
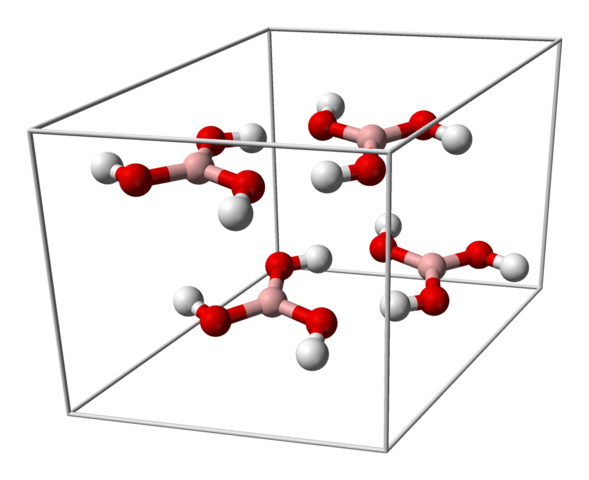 Jednotná bunka pre kryštál H3BO3. Zdroj: Benjah-Bmm27 [verejná doména]
Jednotná bunka pre kryštál H3BO3. Zdroj: Benjah-Bmm27 [verejná doména] Horný obrázok zobrazuje jednotnú bunku zodpovedajúcu tricyklickej kryštalickej štruktúre pre kyselinu boritú, ktorá za určitých podmienok syntézy môže prijať kompaktnú šesťuholníkovú štruktúru. Všimnite si, že existujú štyri molekuly na jednotnú bunku, ktoré sú usporiadané v dvoch vrstvách, A a B, striedavé (nie sú prekrývané na seba).
Z dôvodu symetrie a vedenia odkazov B-OH je možné predpokladať, že B (OH)3 Je to apolar; Existencia intermolekulárnych vodíkových mostov však mení históriu. Každá molekula B (OH)3 Ak chcete dať alebo dostať tri z týchto mostov, s celkom šiestimi interakciami dipól-dipolo, ako sú tie, ktoré sú pozorované na obrázku nižšie:
Môže vám slúžiť: terpenos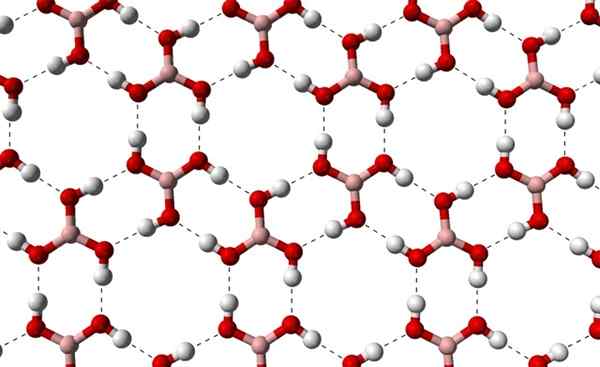 Kryštalické vrstvy H3BO3 pozorované z vyššej osi. Zdroj: Benjah-Bmm27 [verejná doména]
Kryštalické vrstvy H3BO3 pozorované z vyššej osi. Zdroj: Benjah-Bmm27 [verejná doména] Všimnite si, že tieto vodíkové mosty sú smerové interakcie, ktoré riadia kryštály kyseliny boritej, a vytvárajú vzorce okrasných aspektov; Vnútorné krúžky s možno s dostatočným priestorom na oklúziu na niektoré nečistoty, ktoré nie sú v kryštalických defektoch.
Tieto vodíkové mosty, napriek nízkej molekulárnej hmotnosti B (OH)3, Udržiavajú svoje sklenené sklo natoľko súdržné, že potrebuje teplotu 171 ° C na topenie. Nie je známe, aké účinky by mali vysoké tlaky (rádovo GPA) na molekulárnych vrstvách B (OH)3.
Vlastnosti
Mená
IUPAC: Kyselina boritá a trihydrooxidobor. Iné názvy: Kyselina ortodorická, kyselina borraková, sassolite, Borofax a Trihydroxiborano.
Molárna hmota
61,83 g/mol
Fyzický vzhľad
Kryštalické, bezfarebné a priehľadné biele pevné látky. Dosahuje sa tiež ako granule alebo vo forme bieleho prachu. Mierne nemilosrdné dotyk.
Vôňa
Záchod
Príchuť
Mierne horký
Bod topenia
170,9 ° C
Bod varu
300 ° C
Rozpustnosť
Mierne rozpustné v studenej a rozpustnej vode v horúcej vode:
2,52 g/100 ml (0 ° C)
27,50 g/100 ml (100 ° C)
Kyselina boritá je čiastočne rozpustná vo vode a má tendenciu do nej klesať. Táto rozpustnosť má tendenciu zvyšovať prítomnosť kyselín, ako je hydrochlorický, citrický a tartarický.
Rozpustnosť v iných rozpúšťadlách
-Glycerol: 17,5 % pri 25 ° C
-Etylénglykol: 18,5 % pri 25 ° C
-Acetón: 0,6 % pri 25 ° C
-Etylacetát: 1,5 % pri 25 ° C
-Metanol: 172 g/l A 25 ° C
-Etanol: 94,4 g/l A 25 ° C
Koeficient priečneho októbra/vody
Log p = -0,29
Kyslosť (PKA)
9.24. 12.4. 13.3. Toto sú tri konštanty ich príslušných disociácií na uvoľnenie h+ Vo vode.
pH
3,8 - 4,8 (3,3 % vo vodnom roztoku)
5,1 (0,1 molárny)
Tlak vodnej pary
1,6 · 10-6 mmHg
Stabilita
Stabilný
Rozklad
Rozkladá sa, keď sa zahrieva nad 100 ° C a vytvára borickú anhydrid a vodu.
Reaktivita
Kyselina boritá s rozpustnými soli s monovalentnými katiónmi, napríklad: Na2B4Ani7.10 hod2Alebo a nerozpustné soli s dvojmocnými katiónmi, CAB4Ani7.6H2Ani.
Vo vodnom roztoku vytvára kyslé roztok, pričom si myslí, že táto vlastnosť bola spôsobená odčítaním OH skupín- voda. Kyselina boritá je kvalifikovaná ako slabá kyselina typu Lewis.
Kyselina boritá reaguje s glycerolom a manitolom, čím sa zvyšuje kyslosť vodného prostredia. PKA je modifikovaná od 9,2 do 5 v dôsledku tvorby boro-manitol quelato [BC6H8Ani2(Oh)2]-, ktoré uvoľňuje h+.
Príprava
Kyselina boritá je vo voľnom stave v sopečných emanáciách v regiónoch ako Toskánsko Talianska, Lipari Islands av štáte Nevada v USA. Nachádza sa tiež v mineráloch ako Borax, Boracita, Ulexita a Colemanita.
Môže vám slúžiť: halogényKyselina boritá sa pripravuje hlavne reakciou minerálu boraxu (tetraborát sodný sodný) s minerálnymi kyselinami, ako je kyselina chlorovodíková, kyselina sírová atď.
Nat2B4Ani9· 10h2O +hcl => 4 h3Bož3 + 2 NaCl +5 h2Ani
Pripravuje sa tiež hydrolýzou Boro a Diborano Trihaluro.
Kyselina boritá sa pripravuje z kolekcie (CA2B6Anijedenásť· 6 h2Buď). Tento postup spočíva v liečbe minerálov kyselinou sírovou na rozpustenie zlúčenín bóru.
Potom je roztok, v ktorom je prítomná kyselina boritá. Roztok sulfidu vodíka sa ošetrí, aby sa vyzrážalo nečistoty arzénu a železa. Supernatant sa ochladí, aby sa vytvoril zrazenina kyseliny boritej a oddelila ho od suspenzie.
Žiadosti
V priemysle
Kyselina boritá sa používa pri vypracovaní zo sklenených vlákien. Prispel k zníženiu bodu topenia, zvyšuje pevnosť a účinnosť sklenených vlákien: Materiál používaný na posilnenie plastov používaných v nádobách, priemyselných potrubiach a počítačových obvodoch doštičiek.
Kyselina boritá sa podieľa na výrobe borozilizovaného skla, ktoré umožňuje získanie skla odolného voči skla, použiteľné v domácej kuchyni, v sklenenom materiáli laboratórií, fluorescenčných skúmaviek, optických vlákien, LCD obrazoviek atď.
Používa sa v metalurgickom priemysle na stvrdnutie a ošetrenie oceľových zliatin, ako aj uprednostňuje kovovú podšívku materiálov.
Používa sa ako chemická zložka pri hydraulickom štiepení (štiepenie): Metóda používaná pri extrakcii ropy a plynu. Kyselina boritá pôsobí ako spomaľovač horenia v celulózových materiáloch, plastoch a textíliách, ktoré sú impregnované kyselinou boriou, aby sa zvýšila ich požiarna odolnosť.
V medicíne
Kyselina boritá sa používa zriedená pri umývaní očí. Želatínové kapsuly s kyselinou borité sa používajú na liečbu plesňových infekcií, najmä Candida albicans. Používa sa tiež pri liečbe akné.
Kyselina boritá je posypaná ponožkami, aby sa zabránilo infekciám nôh, ako je napríklad noha atléta. Podobne sa pri liečbe vonkajšej zápalu ucha, ako aj u zvierat, používajú roztoky obsahujúce kyselinu boru.
Kyselina boritá sa pridáva do fliaš používaných na zber moču, čo zabraňuje bakteriálnej kontaminácii pred vyšetrením v diagnostických laboratóriách.
Môže vám slúžiť: kyselina indolarová: štruktúra, vlastnosti, získanie, použitiaInsekticíd
Kyselina boritá sa používa na kontrolu proliferácie hmyzu, ako sú šváby, termity, mravce atď. Švábové šváby nezabijú okamžite, pretože najprv ovplyvňuje jeho tráviace a nervové systémy, okrem ničenia jeho exoskeletu.
Kyselina boritá pôsobí pomaly, čo umožňuje hmyz, ktorý ho prehltol, aby prišiel do styku s inými hmyzmi, čím sa šíri otravy.
Uchovávanie
Kyselina boritá sa používa na zabránenie útoku na drevo hubami a hmyzom, ktorý na tento účel používa v spojení s etylénglykolom. Toto ošetrenie je tiež účinné pri kontrole bahna a rias.
Tlmič na pH
Kyselina boritá a jej konjugovaná báza tvoria tlmiaci systém PKA = 9,24, čo naznačuje, že tento tlmič nárazu má najväčšiu účinnosť na alkalické pH, ktoré nie sú obvyklé v živých bytostiach. Avšak tlmič šokov bora sa používa v regulácii pH v bazénoch.
Jadrová reaktory
Kyselina boritá má schopnosť zachytiť tepelné neutróny, čo znižuje možnosť nekontrolovaného jadrového štiepenia, ktoré môže spôsobiť jadrové nehody.
poľnohospodárstvo
Boro je nevyhnutným prvkom rastu rastlín, ktorý vyvolal použitie kyseliny boritej na príspevok prvku. Avšak v nadbytočnej kyseline boritej môže poškodiť rastliny, najmä citrusové plody.
Kontraindikácia
Použitie kyseliny boritej na denudovanej pokožke, rane alebo horiacich produktoch, ktoré umožňuje jej absorpciu. Jedná sa o toxickú zlúčeninu vo vnútri tela av niektorých prípadoch môže spôsobiť mdloby, záchvaty, kŕče, tiky tváre a arteriálnu hypotenziu.
Doktor by sa mal konzultovať s použitím vaginálnych kapsúl kyseliny boritej u tehotných žien, pretože sa zdôrazňuje, že deformácie plodu a zníženie telesnej hmotnosti dieťaťa pri narodení by sa mohli pri narodení produkovať.
Umiestnenie kyseliny boritej, ktorá sa používa ako insekticíd, na miestach, ktoré sú k dispozícii deťom, pretože deti majú väčšiu náchylnosť na toxický účinok kyseliny boritej, pričom v nich ustanovujú smrteľnú dávku v 2 2.000 až 3.000 mg.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). KYSELINA BORITÁ. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). KYSELINA BORITÁ. Databáza pubchem. CID = 7628. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Redaktori Enyclopaedia Britannica. (28. marca 2019). KYSELINA BORITÁ. Encyclopædia Britannica. Získané z: Britannica.com
- Vibrujúci nosič. (9. novembra 2018). Skryté usses kyseliny burovej vo vašom každodennom živote. Získané z: CarrierVibring.com
- Národné informačné centrum pre pesticídy. (s.F.). KYSELINA BORITÁ. Získané z: NPIC.Orst.Edu
- Vypracovanie. (30. novembra 2017). Kyselina boritá: Vlastnosti a použitie tejto chemickej zlúčeniny. Zdroj: kyseliny.Info
- Chlorurosodium. (2019). Kyselina boritá. Získané z: chlorurosodia.com
- Španielska spoločnosť nemocničnej lekárne. (s.F.). Kyselina boritá. [PDF]. Zdroj: Skupiny práce.SEFH.je

