Štruktúra cyklu (C5H10), vlastnosti a použitia
- 1425
- 194
- Adrián Fajnor
On cyklopentano Toto je cyklický uhľovodík, konkrétne cykloalcano. Na druhej strane je to organická zlúčenina, ktorej molekulárny vzorec je C5H10. Dá sa vizualizovať ako uzavretá verzia n-Pentano, otvorený reťazec, v ktorom sa jeho konce spojili stratou dvoch atómov vodíka.
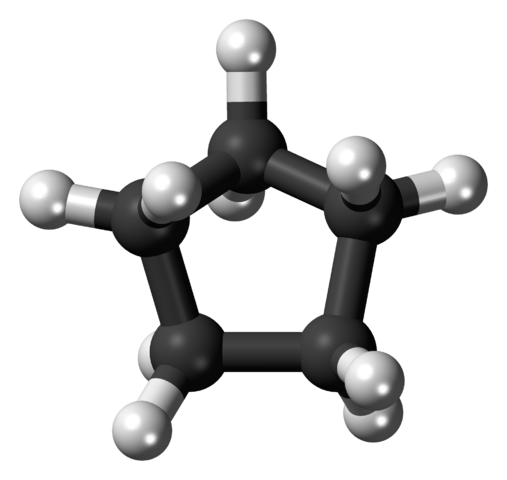
Na spodnom obrázku je zobrazená kostra cyklopentanu. Všimnite si, ako geometrická vaša kostra nosí a vytvára pentagonálny prsteň. Jeho molekulárna štruktúra však nie je plochá, ale predstavuje záhyby, ktoré sa snažia stabilizovať a znižovať napätie vo vnútri kruhu. Cyklistika je vysoko prchavá a horľavá kvapalina, ale nie toľko ako n-Pentano.
 Uhlíková kostra cyklopentanu. Zdroj: Ccroberts [verejná doména]
Uhlíková kostra cyklopentanu. Zdroj: Ccroberts [verejná doména] Vďaka svojej kapacite rozpúšťadla je cyklopentano jedným z najpoužívanejších rozpúšťadiel v chemickom priemysle. Nie je prekvapujúce, že veľa silných výrobkov vône ho obsahuje medzi ich zložením, a preto je horľavá. Používa sa tiež ako expanzné činidlo pre polyuretánové peny používané v chladničkách.
[TOC]
Štruktúra Ciclipentano
Intermolekulárne interakcie
 Molekulárna štruktúra cyklopentanu predstavovaného modelom guľôčok a tyčí. Zdroj: Jynto [CC0]
Molekulárna štruktúra cyklopentanu predstavovaného modelom guľôčok a tyčí. Zdroj: Jynto [CC0] Na prvom obrázku bola zobrazená kostra cyklopentanu. Až teraz vidíme, že je to viac ako jednoduchý pentagón: na jeho okrajoch vynikajú atómy vodíka (biele gule), zatiaľ čo atómy uhlíka tvoria pentagonálny kruh (čierne gule).
Jeho dipólové momenty, ktoré majú iba väzby C-C a C. Namiesto toho zostávajú súdržné vďaka disperzným silám v Londýne, pričom prstene sa snažia naskladať jeden na druhú.
Tento zásobník ponúka určitú kontaktnú plochu, ako je k dispozícii medzi lineárnymi molekulami n-Pentano. V dôsledku toho má cyklopentano väčší bod varu ako n-Pentano, ako aj nižší tlak pary.
Môže vám slúžiť: 7 chemických laboratórnych postupov (jednoduché)Disperzné sily sú zodpovedné za cyklopentano tvorí molekulárny kryštál pri zmrazení pri -94 ° C. Aj keď nie je veľa informácií o jej kryštalickej štruktúre, je to polymorfné a má tri fázy: I, II a III, pričom je fázou II nepokojná zmes I a III.
Konformácia a anulárne napätie
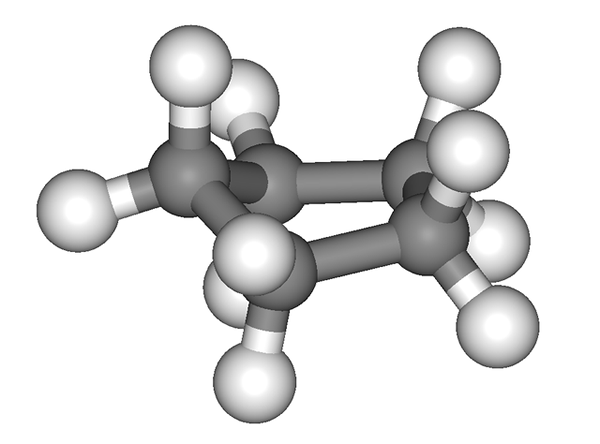 Cyclopentano prsteň nie je úplne plochý. Zdroj: EDGAR181 [verejná doména]
Cyclopentano prsteň nie je úplne plochý. Zdroj: EDGAR181 [verejná doména] Predchádzajúci obrázok vyvoláva falošný dojem, že cyklus je plochý; Ale nie je to tak. Všetky ich atómy uhlíka majú hybridizáciu SP3, Takže ich orbitály sa nenachádzajú v rovnakom lietadle. Podobne, akoby to nestačilo, atómy vodíka sú veľmi blízko k sebe, silne sa odpudzujú, keď sú zatienené.
Hovorí sa teda o konformáciách, z ktorých jednou z nich je polovica kresla (vynikajúci obraz). Z tohto hľadiska je zrejmé, že Cyclopentano Ring predstavuje záhyby, ktoré pomáhajú znižovať jeho rušenie zrušené kvôli ich atómom uhlíka tak blízko seba navzájom.
Toto napätie je spôsobené skutočnosťou, že väzby C-C majú uhly nižšie ako 109'5 °, ideálna hodnota pre produkt tetraedrálneho prostredia ich hybridizácií SP3.
Napriek tomuto napätiu je však cyklus stabilnejšia a menej horľavá zlúčenina ako Pentan. To sa dá skontrolovať porovnaním svojich bezpečnostných kosoštvorcov, v ktorých má horlosť cyklu 3, zatiaľ čo v Pentane, 4.
Vlastnosti Ciclipentano
Fyzický vzhľad
Bezfarebná tekutina s jemnou vôňou podobnou olejom.
Môže vám slúžiť: etapy chémieMolárna hmota
70,1 g/mol
Bod topenia
-93,9 ° C
Bod varu
49,2 ° C
Bod vzplanutia
-37,2 ° C
Teplota
361 ° C
Odparovanie
28,52 kJ/mol pri 25 ° C
Hrebeň
0,413 MPa · s
Index lomu
1 4065
Tlak vodnej pary
45 kPa pri 20 ° C. Tento tlak však zodpovedá približne 440 bankom n-Pentano: 57,90 kpa.
Tu sa prejavuje účinok štruktúry: cyklopentano -kruh umožňuje účinnejšie intermolekulárne interakcie, ktoré kohézne a zachováva jej molekuly viac v kvapaline v porovnaní s lineárnymi molekulami lineárnych molekúl n-Pentano. Preto má väčší tlak pary.
Hustota
0,751 g/cm3 pri 20 ° C. Na druhej strane, jeho výpary sú 2,42 -krát hustejšie ako vzduch.
Rozpustnosť
V liter vody pri 25 ° C, 156 mg cyklopentano rozpusteného, kvôli jeho hydrofóbnemu charakteru. Je však miešateľný v apolárnych rozpúšťadlách, ako sú iné parafíny, etherres, benzén, tetrachlorid uhlíka, acetón a etanol.
Koeficient priečneho októbra/vody
3
Reaktivita
Cyklistika je stabilná, ak je správne uložená. Nie je to reaktívna látka, pretože jej spojenia C-H alebo C-C nie je ľahké zlomiť, aj keď by to viedlo k uvoľňovaniu energie spôsobenej napätím kruhu.
V prítomnosti kyslíka bude horieť pri spaľovacej reakcii, či už úplné alebo neúplné. Pretože cyklus je veľmi prchavá zlúčenina, musí sa skladovať na miestach, kde nemôže byť vystavený žiadnemu zdroju tepla.
Medzitým v neprítomnosti kyslíka bude cyklopentano utrpieť pyrolýznu reakciu, ktorá sa rozkladá v menších a nenasýtených molekulách. Jedným z nich je 1-pentén, ktorý demonštruje, že teplo prelomí cyklopentano-kruh, aby vznikol alkeén.
Môže vám slúžiť: metyl salicylátNa druhej strane, cyklopentano môže reagovať s brómom pod ultrafialovým žiarením. Týmto spôsobom je jedna z jeho väzieb C-H nahradená C-BR, čo môže byť naopak nahradené inými skupinami; A tak sa objavujú deriváty cyklopentano.
Žiadosti
Priemyselné rozpúšťadlo
Hydrofóbny a apolárny charakter cyklopentanu sa vyrába pomocou stupňa rozpúšťadla, vedľa ostatných parafínových rozpúšťadiel. Z tohto.
Etylénový zdroj
Keď je cyklopentano vystavený pyrolýze, jednou z najdôležitejších látok, ktoré vytvára, je etylén, ktorý má nespočetné množstvo aplikácií vo svete polymérov.
Polyuretánové izolačné peny
Jedným z najvýznamnejších použití Cycopentana je expanzné činidlo na výrobu polyuretánových izolačných penov; To znamená, že cyklopentano výpary, ktoré sledujú svoj veľký tlak, rozširujú polymérny materiál, až kým mu nedajú penu s prospešnými vlastnosťami, ktoré sa majú použiť v rámci chladničiek alebo mrazničiek.
Niektoré spoločnosti sa rozhodli nahradiť HFC Cyclopentano pri výrobe izolačných materiálov, pretože neprispieva k zhoršeniu ozónovej vrstvy a tiež znižuje uvoľňovanie skleníkových plynov do životného prostredia.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Wikipedia. (2020). Cyklopentán. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Cyklopentán. Databáza pubchem, CID = 9253. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Elsevier B.Vložka. (2020). Cyklopentán. Vedecký. Zdroj: ScienceDirect.com
- GE spotrebiče. (11. januára 2011). Zníženie emisií skleníkových plynov vo výrobných zariadeniach GE v chladničke. Obnovený z: Pressroom.Prepadnutý.com
- « Emulzný proces emulzie, molekulárne aspekty, aplikácie
- Priemyselné mesto Ako sa narodí, štruktúra, dôsledky, problémy »

