Typy cyklooxygenázy, reakcia, inhibítory
- 4741
- 392
- Mgr. Pravoslav Mokroš
Ten cykloxygenázy (Coxs), známe tiež ako syntéza prostaglandínu H syntázy alebo endoperoxidové syntézy prostaglandínu, sú enzýmy mastných kyselín oxygenázy, ktoré patria do superrodiny myeloperoxidázy a nachádzajú sa u všetkých zvierat stavovcov.
Cycoxygenázy sú bifunkčné enzýmy, pretože majú dve rôzne katalytické aktivity: jedna aktivita cyklooxygenázy a druhá peroxidáza, ktorá im umožňuje katalyzovať Bis-Oxygenácia a redukcia kyseliny arachidónovej na vytvorenie prostaglandínu.
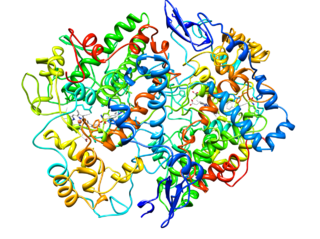
 Katalizovaná reakcia cykloxygenázovými enzýmami (zdroj: pancrat [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons)
Katalizovaná reakcia cykloxygenázovými enzýmami (zdroj: pancrat [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons) Neboli nájdené v rastlinách, hmyzu alebo v jednobunkových organizmoch, ale v bunkách stavovcov tieto enzým, vezikuly atď.
Prvé detekcie produktov syntetizovaných cyklooxygenázami sa uskutočnili v semenných tekutinách, takže sa pôvodne predpokladalo, že ide o látky vyrábané v prostate, a preto sa nazývali „prostaglandíny“.
Dnes je známe, že prostaglandíny sú syntetizované vo všetkých tkanivách zvierat stavovcov a dokonca aj v organizmoch, ktoré nemajú prostatu, a že rôzne izoméry týchto molekúl majú rôzne funkcie v rôznych fyziologických a patologických procesoch, ako je napríklad horúčka, citlivosť na citlivosť Citlivosť na bolesť alebo algees, zápal, trombózu, mytegenéza, vazodilatácia a vazokonstrikcia, ovulácia. Funkcia obličiek atď.
[TOC]
Chlapci
Bola hlásená existencia dvoch typov cyklooxygenáz medzi stavovcami. Prvý, ktorý sa objaví a vyčistí, je známy ako COX-1 alebo jednoducho COX a bol prvý.
Druhá cykloxigenáza objavená medzi eukaryotesmi bola COX-2 v roku 1991. K dnešnému dňu sa dokázalo, že všetky zvieratá stavovcov, vrátane chrupavkových rýb, kostných rýb, vtákov a cicavcov, majú dva gény, ktoré kódujú Cox enzýmy.
Môže vám slúžiť: Cirkulácia húb: živiny, látky, osmoreguláciaJeden z nich, COX-1, kóduje pre cyklooxigenúzu 1, ktorá je konštitutívna, zatiaľ čo gén Cox-2 kóduje indukovateľnú cyklooxygenázu.
Charakteristiky oboch génov a ich enzymatických výrobkov
Enzýmy COX-1 a COX-2 sú dosť podobné, čo sa chápe ako 60-65% podobnosť medzi svojimi aminokyselinovými sekvenciami.
Gény COX-1 Ortelógovia (gény v rôznych druhoch, ktoré majú rovnaký pôvod) u všetkých druhov zvierat stavovcov, produkujú proteíny COX-1, ktoré zdieľajú až 95% identity svojich aminokyselinových sekvencií, čo platí aj pre ortologistov Cox-2, ktorých produkty zdieľajú identitu 70 až 90%.
Cnidarians a Ascidias majú tiež dva gény Cox, Ale líšia sa od tých iných zvierat, takže niektorí autori predpokladajú, že tieto gény sa mohli objaviť v nezávislých duplicitných udalostiach od toho istého spoločného predka.
COX-1
Gen Cox-1 váži približne 22 kb a konštitutívne sa vyjadruje na kódovanie proteínu COX-1, ktorý má pred spracovaním asi 600 aminokyselinových odpadov, pretože má hydrofóbny signálny peptid po tom, ktorého odstránenie platí proteín s približne 576 aminokyselinami.
Tento proteín je hlavne v endoplazmatickom retikule a jeho všeobecná štruktúra je vo forme homodiméru, tj dva identické polypeptidové reťazce, ktoré sú spojené s tvorbou aktívneho proteínu.
Cox-2
Gen Cox-2, na druhej strane, váži asi 8 kb a jeho expresia je indukovaná cytokínmi, rastovými faktormi a inými látkami. Toto kóduje enzým COX-2, ktorý má, vrátane signálneho peptidu, 604 aminokyselinového odpadu a 581 po spracovaní.
Môže vám slúžiť: anaeróbne dýchanieTento enzým je tiež homodimérický a je medzi endoplazmatickým retikulom a zabalenými jadrovýmiarmi.
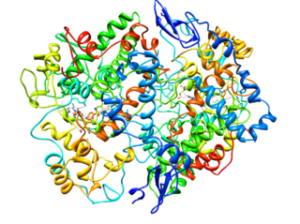 Molekulárna štruktúra cykloxygenázy typu 2 (COX-2) (zdroj: cytochróm C v angličtine Wikipedia [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons)
Molekulárna štruktúra cykloxygenázy typu 2 (COX-2) (zdroj: cytochróm C v angličtine Wikipedia [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons) Z analýzy ich štruktúr sa zistilo, že enzým COX-1 a COX-2 English Epidermálny rastový faktor).
V tomto module sú extrémne zachované disulfidové väzby alebo mosty, ktoré fungujú ako „dimerizačná doména“ medzi dvoma polypeptidmi každého homodimérneho enzýmu.
Proteíny majú tiež amfipatické vrtule, ktoré uľahčujú ukotvenie jednej z membránových vrstiev. Okrem toho má katalytická doména oboch dve aktívne miesta, jedno s aktivitou cyklooxygenázy a druhá s aktivitou peroxidázy.
Oba enzýmy sú extrémne zachované proteíny, ktoré patria medzi rôzne druhy, malé významné rozdiely, pokiaľ ide o mechanizmy dimerizácie a spojenia s membránou, ako aj niektoré charakteristiky ich katalytických domén.
Coxové proteíny majú navyše glykozylačné miesta, ktoré sú nevyhnutné pre ich prevádzku a ktoré sú úplne zachované.
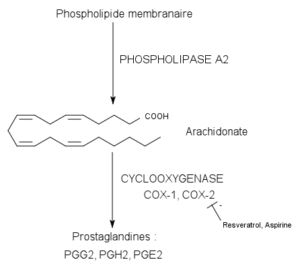
Reakcia
Enzýmy cykloxygenázy 1 a 2 sú zodpovedné za katalyzáciu prvých dvoch krokov biosyntézy prostaglandínu, ktoré začínajú konverziou kyseliny arachidónovej na prekurzory prostaglandínov známych ako hydroperoxi-endoperoxid PGG2.
Aby tieto enzýmy vykonávali svoje funkcie, musia sa najprv aktivovať prostredníctvom procesu závislého od ich aktivity peroxidázy. Inými slovami, jeho hlavná aktivita závisí od redukcie peroxidového substrátu (sprostredkovaného aktívnym miestom peroxidázy), takže dochádza k oxidácii železa spojenej so skupinou HEMO, ktorá slúži ako kofaktor.
Môže vám slúžiť: Monera Kingdom: Charakteristiky, klasifikácia a príkladyOxidácia skupiny Hemo spôsobuje tvorbu tyrosilového radikálu v aktívnej cyklooxygenáze, ktorá aktivuje enzým a podporuje iniciáciu cyklooxygenázy reakcie. Táto aktivačná reakcia sa môže vyskytnúť iba raz, pretože sa regeneruje Tyrosil radikál počas poslednej reakcie trasy.
Inhibítory
Cykloxygenázy sa podieľajú na syntéze prostaglandínov, ktoré sú hormónmi s funkciami pri ochrane črevnej sliznice, pri agregácii krvných doštičiek a pri regulácii funkcie obličiek, okrem účasti na procesoch zápalu, bolesti a horúčky a horúčky.
Vzhľadom na skutočnosť, že tieto enzýmy sú kľúčom k produkcii týchto hormónov, najmä tých, ktoré sa týkajú zápalových procesov, sa mnohé farmakologické štúdie zameriavali na inhibíciu cyklooxygenáz.
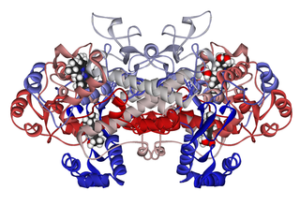 Molekulárna štruktúra cykloxigenázy 1 spojená s ibuprofenom (zdroj: Fvasconcellos 5. mája 2007 [verejná doména] cez Wikimedia Commons)
Molekulárna štruktúra cykloxigenázy 1 spojená s ibuprofenom (zdroj: Fvasconcellos 5. mája 2007 [verejná doména] cez Wikimedia Commons) Ukázalo sa teda, že mechanizmus pôsobenia mnohých nesteroidných protizápalových liekov súvisí s ireverzibilným alebo reverzibilným (inhibičným) acetyláciou aktívnej cyklooxigázy v týchto enzýmoch.
Medzi tieto lieky patrí piroxikam, ibuprofén, aspirín, flurprofén, diklofenak, naproxén a ďalšie.
Odkazy
- Botting, r. M. (2006). Inhibítory cyklooxygenázy: mechanizmy, selektivita a použitie. Journal of Physiology and Pharmacology, 57, 113.
- Chandrasekharan, n. Vložka., & Simmons, D. L. (2004). Cyklooxygenázy. Genome Biology, 5 (9), 241.
- Fitzpatrick, f. Do. (2004). Enzýmy cyklooxygenázy: regulácia a funkcia. Súčasný farmaceutický dizajn, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, L., & Fulton,. M. (2002). Inhibítory cyklooxygenázy blokujú rast buniek, zvyšuje ceramid a inhibuje bunkový cyklus. Výskum a liečba rakoviny prsníka, 76 (1), 57-64.
- Rauzer, c. Do., & Marnett, L. J. (2009). Cyklooxygenázy: Štrukturálne a funkčné poznatky. Journal of Lipid Research, 50 (Supplement), S29-S34.
- Vane, J. R., Bakhle a. Siež., & Botting, R. M. (1998). Cyclooxygenses 1 a 2. Ročný prehľad farmakológie a toxikológie, 38 (1), 97-120.

