Cyklistické vlastnosti, reakcie, použitia, príklady
- 1325
- 183
- Blažej Hrmo
Ten Cykloalcanos Sú rodinou nasýtených uhľovodíkov so všeobecným vzorcom CnH2n ktorý sa zhoduje s alkénmi; s rozdielom v tom, že zjavná nenasýtenie nie je spôsobené dvojitou väzbou, ale krúžkom alebo cyklom. Preto sa považujú za izoméry Alquenos.
Vytvárajú sa, keď lineárne alkány zjednocujú konce svojich reťazcov, aby vznikli uzavretá štruktúra. Rovnako ako v prípade alkánov, aj cykloalcan môže vykazovať rôzne veľkosti, molekulárne hmoty, substitúcie alebo dokonca systémy zložené z viac ako jedného kruhu (polycykliky).
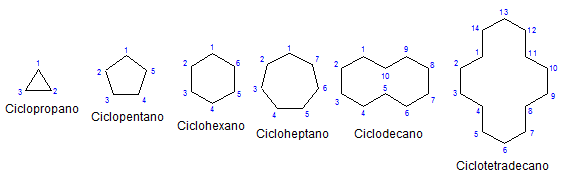
 Niektoré monocyklické cykloalcanos. Zdroj: Mephisto SPA Via Wikipedia.
Niektoré monocyklické cykloalcanos. Zdroj: Mephisto SPA Via Wikipedia. Zvyšok, chémia a fyzicky sú podobné alkánm. Majú iba uhlíky a hydrogény, sú to neutrálne molekuly, a preto interagujú cez van der stien sily. Slúžia tiež ako palivá a uvoľňujú teplo, keď horia v prítomnosti kyslíka.
Prečo sú cykloalcanos nestabilnejšie ako ich náprotivky s otvoreným reťazcom? Dôvod môže byť podozrenie na pozorovanie príkladov cykloalcanos reprezentovaných v hornom obrázku: Existujú stérické (priestorové) napätie a prekážky.
Všimnite si, že čím menej uhlíkov (uvedené v modrej), tým viac je štruktúra uzavretá; A opak sa stane, keď sa zvyšujú, otáčajú sa ako náhrdelník.
Malé cykloalcanos sú plynné a ako ich veľkosť zvyšuje svoje intermolekulárne sily. V dôsledku toho môžu byť kvapalina schopné rozpúšťať tuky a apolárne, mazivo alebo tuhé látky, ktoré vyzerajú tmavé farby a vlastnosti, ako sú asfaltové farby.
[TOC]
Fyzikálne a chemické vlastnosti
Polarita
Ak sa skladá iba z uhlíkov a hydrogénov, atómy, ktoré sa príliš nelíšia v elektronegativite, je to molekuly cykloalku apolárne, a preto im chýba dipólový moment.
Nemôžu interagovať prostredníctvom dipólových dipólových síl, ale závisia konkrétne od londýnskych síl, ktoré sú slabé, ale ktoré sa zvyšujú s molekulárnou hmotnosťou. Preto sú malé cykloalcanos (s menej ako piatimi uhlíkom) plynné.
Intermolekulárne interakcie
Na druhej strane, pretože sú to prstene, cykloalcanos majú väčšiu kontaktnú oblasť, ktorá uprednostňuje londýnske sily medzi ich molekulami. Sú teda zoskupené a interagujú lepšie v porovnaní s alkanami; A preto sú jeho body varu a fúzne vyššie.
Tiež, pretože majú dva menej atómov vodíka (CnH2n Pre cykloalcanos a cnH2n+2 Pre alkány) sú ľahšie; A pridáva sa k tomu skutočnosť, že je to najväčšia kontaktná oblasť, znižuje objem obsadený jeho molekulami, a preto sú hustejšie.
Nasýtenie
Prečo sú cykloalcanos ako nasýtené uhľovodíky klasifikované? Pretože majú, ako začleňujú molekulu vodíka; Pokiaľ sa prsteň neotvorí a v takom prípade by sa stali jednoduchými alkánmi. Aby sa uhľovodík považoval za nasýtený, musí mať maximálny počet odkazov C-H.
Môže vám slúžiť: Potentiometer (fameter)Stabilita
Chemicky sú veľmi podobné alkánm. Obidve majú odkazy na C-C a C-. Ich relatívna stabilita sa však líši, čo je možné experimentálne overiť meraním ich spaľovacích teplôt (AHhrebeň).
Napríklad v porovnaní s AHhrebeň Pre propán a cyklopropo (reprezentované trojuholníkom na obrázku) je 527,4 kcal/mol a 498,9 kcal/mol, respektíve.
Detail je, že cyklopropánhrebeň menšie (471 kcal/mol), pretože sú to tri skupiny metylénu, cho2; Ale v skutočnosti uvoľňuje viac tepla, čo odráža nestabilitu väčšiu ako odhadované. Táto prebytočná energia sa hovorí, že je spôsobená napätím vo vnútri kruhu.
A v skutočnosti tieto napätia riadia a rozlišujú reaktivitu alebo stabilitu cykloalcanos, vzhľadom na alkány, proti špecifickým reakciám. Pokiaľ napätie nie je príliš vysoké, cykloalcanos majú tendenciu byť stabilnejšie ako ich topy.
Menovanie
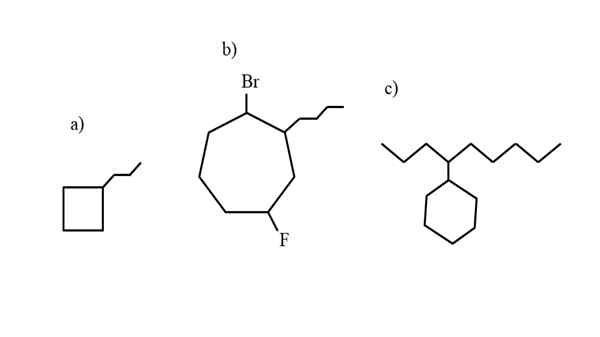 Niektoré príklady substituovaného cykloalcanu na testovanie pravidiel nomenklatúry. Zdroj: Gabriel Bolívar.
Niektoré príklady substituovaného cykloalcanu na testovanie pravidiel nomenklatúry. Zdroj: Gabriel Bolívar. Nomenklatúra riadená IUPAC pre cykloalcanos sa nelíši príliš veľa ako v Alkánoch. Najjednoduchším pravidlom všetkých je umiestniť cyklus predponu na názov alkáne, ktorého sa vytvorí cykloalcano.
Napríklad n-hexán, Cho3Chvály2Chvály2Chvály2Chvály2Chvály3, Cyklohexan sa získa (reprezentovaný šesťuholníkom na prvom obrázku). Rovnakým spôsobom sa to stáva s cyklopropánom, cyklobutánom atď.
Teraz môžu tieto zlúčeniny trpieť substitúciami jedným z ich hydrogénov. Ak je počet uhlíkov kruhu vyšší ako počet substituentov prenájmu, prsteň sa považuje za hlavný reťazec; Toto je prípad a) pre vynikajúci obraz.
Všimnite si, že v a) cyklobután (štvorec) má viac uhlíkov ako skupina propilus s ním; Potom je táto zlúčenina pomenovaná ako propylciclobutano.
Ak existuje viac ako jeden substituent, mali by byť pomenované v abecednom poradí a takým spôsobom, že majú najmenšie možné číslo vyhľadávača. Napríklad b) sa nazýva: 1-Bromo-4-Fluoro-2-butilcippano (a nie 1-Bromo-5-fluoro-7-butylciclooheptano, ktorý by bol nesprávny).
A nakoniec, keď má alquilalický substituent viac uhlíkov ako prsteň, hovorí sa, že ten je náhradnou skupinou hlavného reťazca. C) sa tak nazýva: 4-cyklohexilnonano.
Môže vám slúžiť: oxidy kovovŠtruktúra
Odchodom z nahradených cykánov je vhodné zamerať sa iba na svoje štrukturálne základne: prstene. Tieto boli zastúpené na prvom obrázku.
Pri ich pozorovaní môže vzniknúť falošná myšlienka, že takéto molekuly sú ploché; Ale s výnimkou Cyclopropo sú jeho povrchy „Zigzagenantes“, pričom uhlíky klesajú alebo nahrávajú vo vzťahu k rovnakej rovine.
Je to preto, že na spustenie všetkých uhlíkov majú hybridizáciu SP3, a preto predstavte tetraedrálne geometrie s 109,5 ° odkazmi na prepojenie. Ale ak je geometria krúžkov starostlivo pozorovaná, nie je možné, aby boli ich uhly; Napríklad uhly v trojuholníku cyklopropánu sú 60 °.
To je známe ako uhlové napätie. Čím väčšie sú krúžky, uhol medzi odkazmi C-C je bližšie k 109,5 °, čo spôsobuje pokles takéhoto napätia a zvýšenie stability pre cykloalcan.
Ďalší príklad je pozorovaný v cyklobutáne, ktorého uhly spojenia sú 90 °. Už v cyklopentane sú jeho uhly 108 ° a z cyklohexu.
Konformácia
Okrem uhlového napätia existujú aj ďalšie faktory, ktoré prispievajú k napätiu, ktoré sa vyskytuje Cycloalcanos.
Odkazy C-C sa nemôžu otáčať bez toho, aby to znamenalo, že by to znamenalo, že celá štruktúra sa „chveje“. Tieto molekuly teda môžu prijať veľmi dobre definované priestorové konformácie. Účelom týchto pohybov je znížiť napätie spôsobené zatmením atómov vodíka; to je, keď jeden pred druhým.
Napríklad konformácie pre cyklobután sa podobajú motýľovi, ktorý bije jeho krídla; tie cyklopentano, obálka; Tí z cyklohexunu, lode alebo stoličky a čím väčší prsteň, tým väčšie číslo a tvary, ktoré môžu prijať vo vesmíre.
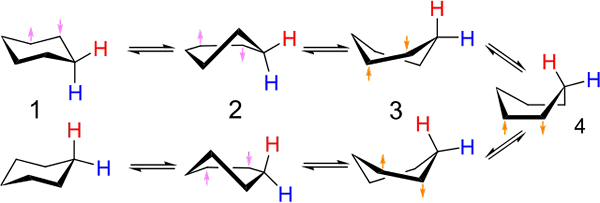 Investície medzi konformáciou stoličky a lode pre cyklohexán. Zdroj: Kministi [CC0].
Investície medzi konformáciou stoličky a lode pre cyklohexán. Zdroj: Kministi [CC0]. Vynikajúci obrázok ukazuje príklad takýchto konformácií pre cyklohexán. Všimnite si, že údajný plochý šesťuholník sa skutočne javí skôr ako stolička (naľavo od obrázka) alebo loď (vpravo). Vodík je reprezentovaný s červenými textami a ďalším s modrými textami, ktoré naznačujú, ako sa ich relatívne pozície menia po investíciách.
V (1), keď je vodík kolmá na kruhovú rovinu, hovorí sa, že je v axiálnej polohe; A keď je to paralelné s tým, hovorí sa, že je v rovníkovej polohe.
Reakcie
Reakcie, ktoré môže cykloalcan trpieť, sú rovnaké ako v prípade alkánov. Obe horia v prítomnosti nadbytočného kyslíka v typických spaľovacích reakciách na výrobu oxidu uhličitého a vody. Podobne môžu obidve utrpieť halogmácie, v ktorých je vodík nahradený atómom halogénu (F, Cl, Br, I).
Môže vám slúžiť: Výhody a nevýhody chémie zdravia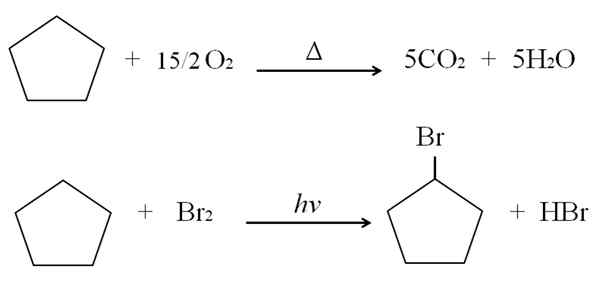 Cyklopentano reakcie. Zdroj: Gabriel Bolívar.
Cyklopentano reakcie. Zdroj: Gabriel Bolívar. Ako príklad je uvedené nad spaľovacími a halogenačnými reakciami pre Cyclopentano. Jeden mól horí v prítomnosti tepla a 7,5 mólov molekulárneho kyslíka, aby sa rozložil na co2 a h2Ani. Na druhej strane, v prítomnosti ultrafialového a brome.
Žiadosti
Použitie cykloalcanos do veľkej miery závisí od ich počtu uhlíkov. Najľahší, a teda plynný, kedysi slúžil na kŕmenie plynových žiaroviek verejných svetiel.
Kvapaliny majú medzitým zisky ako rozpúšťadlá olejov, tukov alebo komerčných výrobkov apolárnej povahy. Medzi nimi môžete spomenúť cyklopentano, cyklohexan a cykloheptán. Podobne sa často používajú v bežných operáciách v laboratóriách Petróleos alebo pri formulácii paliva.
Ak sú ťažšie, môžu sa použiť ako mazivo. Na druhej strane môžu tiež predstavovať východiskový materiál pre syntézu liekov; Rovnako ako karboplatin, ktorý obsahuje vo svojej štruktúre cyklobutánový prsteň.
Príklady cychannelu
Nakoniec sa vráti na začiatok článku: Obrázok s niekoľkými non -presadzovanými cykloalcanosmi.
Na zapamätanie si cykloalcanov stačí myslieť na geometrické figúrky: trojuholník (cyklopropán), štvorcový (cyklobután), Pentagon (Cyclopentano), šesťuholník.
Čím väčší prsteň, tým menej pripomína jeho geometrickú postavu. Už bolo zrejmé, že cyklohexan je všetko okrem šesťuholníka; To isté sa deje evidentne s cyklootetradecanom (štrnásť uhlíkov).
Bod prichádza tam, kde sa budú správať ako náhrdelníky, ktoré sa dajú zložiť, aby sa znížilo napätie svojich odkazov a zatmenia naplno.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Chémia librettexts. (2. júna 2019). Pomenovanie cykloalkánov. Získané z: Chem.Librettexts.orgán
- Wikipedia. (2019). Cykloalkan. Zdroj: In.Wikipedia.orgán
- Clark Jim. (2015). Predstavovanie alkaov a cykloalkánov. Získané z: Chemguide.co.Uk
- James Ashenhurst. (2019). Konformácie a cykloalkány. Hlavná organická chémia. Získané z: Masterorganicchemistry.com
- Fernández Germán. (s.F.). Cykloalcanos-toria. Organická chémia. Získané z: chemicicaorganica.orgán

