Funkcie a vlastnosti Centriolos
- 2448
- 614
- Alfréd Blaho

Ten Centriolos Sú to valcové bunkové štruktúry zložené zo skupín mikrotubulov. Sú tvorené proteínom tubulínu, ktorý sa nachádza vo väčšine eukaryotických buniek.
Pridružený pár centrilov, obklopený hromadnou správou hustého materiálu nazývaného pericentriolárny materiál (PCM), tvorí štruktúru nazývanú stred.
Funkciou centriolov je nasmerovať zostavenie mikrotubulov, zúčastňovať sa na bunkovej organizácii (poloha jadra a priestorové dispozície bunky), tvorbu a funkciu bičíkov a cilie (valce) a delenia buniek (mitóza a meióza).
Centriolos sa nachádzajú v bunkových štruktúrach známych ako živočíšne bunky a v rastlinných bunkách chýbajú.
Defekty v štruktúre alebo počte centriolov v každej bunke môžu mať značné následky na fyziológiu organizmu, ktoré spôsobujú zmeny v reakcii na stres počas zápalu, mužská neplodnosť, neurodegeneratívne choroby a tvorba nádorov.
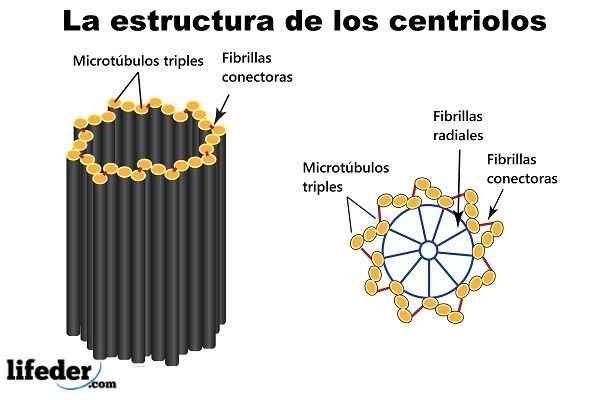
Centriole je valcovitá štruktúra. Dvojica pridružených centriolov, obklopená hromadnou správou hustého materiálu (nazývaného „pericentriolárny materiál“ alebo PCM), tvorí zlúčenú štruktúru nazývanú „centrá“.
Považovali sa za nedôležité až pred niekoľkými rokmi, keď sa hlavné organely uzavreli pri vykonávaní bunkového delenia a duplikácie (mitóza) v eukaryotických bunkách (hlavne u ľudí a iných zvierat).
Centriol
Deväť mikrotubulových trojíc usporiadaných okolo obvodu (tvoriaci krátky dutý valec) sú „stavebné bloky“ a hlavná štruktúra centiole.
Po mnoho rokov bola štruktúra a funkcia centriolov ignorovaná, hoci v 80. rokoch 20. storočia boli centrá vizualizované optickou mikroskopiou.
Theodor Boveri publikoval v roku 1888 kľúčové dielo, ktoré popisovalo pôvod centier z spermie po oplodnení. Vo svojej krátkej komunikácii v roku 1887 Boveri napísal:
„Stredisko predstavuje dynamické centrum bunky; Jeho delenie vytvára centrá vytvorených dcérskych buniek, okolo ktorých sú všetky ostatné bunkové komponenty organizované symetricky ... Centrá sú skutočným deliacim orgánom bunky, polovica jadrového a bunkového delenia “(Scheer, 2014: 1). [Autor preklad].
Krátko po polovici dvoch storočia, s vývojom elektronickej mikroskopie, študoval a vysvetlil Paul Schafer správanie Centrioles.
Bohužiaľ, táto práca bola z veľkej časti ignorovaná kvôli skutočnosti, že záujem výskumných pracovníkov sa začal zameriavať na zistenia Watsona a Kricka na DNA.
Centrum

Dvojica centriolov, umiestnených v susedstve jadra a kolmo na seba je „centrovanie“. Jeden z centier je známy ako „otec“ (alebo matka). Druhý je známy ako „syn“ (alebo dcéra; je o niečo kratšia a má svoju základňu pripútanú k základni matky).
Proximálne konce (v súvislosti s dvoma centrami) sú ponorené do „oblaku“ proteínu (možno až 300 alebo viac) známeho ako stredisko organizácie mikrotubulov (MTOC), pretože poskytuje potrebný proteín na výstavbu mikrotubuly.
Môže vám slúžiť: životaschopnosť výskumuMTOC je tiež známy ako „pericentriolárny materiál“ a má negatívne zaťaženie. Inverzne sú distálne konce (mimo spojenia dvoch centriolov) pozitívne načítané.
Dvojica centriolov spolu s okolitým MTOC je známa ako „centrum“.
Duplikácia centier
Keď sa Centrioles začnú duplikovať, otec a syn sa mierne oddeľujú a potom každý centriole začne vytvárať vo svojej základni nové Centriolo: Otec s novým synom a syn s novým synom („vnuk“ ).
Zatiaľ čo dochádza k duplikácii centraole, jadrová DNA je tiež duplikovaná a oddelená. To znamená, že súčasný výskum ukazuje, že duplikácia centiole a separácia DNA sú nejako spojené.
Duplikácia a delenie buniek (mitóza)

Mitotický proces je často opísaný z hľadiska iniciatívnej fázy, známej ako „rozhranie“, nasledované štyrmi fázami vývoja.
Počas rozhrania sa centrioly zdvojnásobia a rozdeľujú na dva páry (jeden z týchto rovesníkov sa začína pohybovať smerom k opačnej strane jadra) a DNA je rozdelená.
Po duplikácii centriolov sa mikrotubuly centriolu rozširujú a zarovnajú pozdĺž hlavnej osi jadra, čím tvoria „mitotické vreteno“.
V prvej zo štyroch fáz vývoja (fáza I alebo „Profas“), chromozómy kondenzujú a prístup a jadrová membrána začína oslabovať a rozpúšťať sa. Zároveň sa tvorí mitotické vreteno s párami centriolu, ktoré sa teraz nachádzajú na koncoch vretena.
V druhej fáze (fáza II alebo „metafáza“) sú reťazce chromozómov zarovnané s osou mitotického vretena.
V tretej fáze (fáza III alebo „anafáza“) sa chromozomálne reťazce rozdelia a posúvajú sa smerom k opačným koncom mitotického vretena, teraz predĺžené.
Nakoniec, v štvrtej fáze (fáza IV alebo „telofáza“) sa tvoria nové jadrové membrány okolo samostatných chromozómov, mitotické vreteno je vrátené a separácia buniek sa začína dokončiť polovicou cytoplazmy, ktorá ide s každým novým jadrom.
Na každom konci mitotického vretena má páry centiumy dôležitý vplyv (zjavne súvisiaci s silami vyvíjanými elektromagnetickými poľami generovanými negatívnym a pozitívnym zaťažením ich proximálnych a distálnych koncov) v celej bunke bunkového delenia bunky.
Centrá a imunitná reakcia
Expozícia stresu ovplyvňuje funkciu, kvalitu a trvanie života organizmu. Generované napätie, napríklad infekciou, môže viesť k zápalu infikovaných tkanív, čo aktivuje imunitnú reakciu v tele. Táto reakcia chráni postihnuté telo a eliminuje patogén.
Mnoho aspektov funkcií imunitného systému je dobre známe. Molekulárne, štrukturálne a fyziologické udalosti, do ktorých sú zapojené centrá, sú však stále záhadou.
Môže vám slúžiť: Experimentálna správaPosledné štúdie objavili neočakávané dynamické zmeny v štruktúre, umiestnení a funkcii centier v rôznych podmienkach súvisiacich so stresom. Napríklad po napodobňovaní podmienok infekcie sa zistilo zvýšenie produkcie PCM a mikrotubuly v bunkách rozhrania.
Centrá v imunitných synapsiách
Centrá majú veľmi dôležitú úlohu pri štruktúre a funkcii imunitných synapsií (SI). Táto štruktúra je tvorená špecializovanými interakciami medzi T bunkou a bunkou prezentujúcou antigén (CPA). Táto interakcia bunkových buniek začína migráciu centrovania smerom k SI a jeho následné spojenie s plazmovou membránou.
Stredové spojenie v SI je podobné ako v rámci valézy pozorovanej počas valézy. V tomto prípade však nezačína zostavenie cilie, ale podieľa sa na organizácii SI a sekrécie cytotoxických vezikúl, aby sa zamyslili cieľové bunky, čím sa stáva kľúčovým orgánom v aktivácii T buniek.
Stredné a tepelné stres
Centrá sú cieľom „molekulárneho“ chaperonas (sada proteínu, ktorého funkciou je pomôcť skladacieho zostavy a transportu buniek iných proteínov), ktoré poskytujú ochranu pred vystavením tepelnému šoku a stresu.
Medzi stresové faktory, ktoré ovplyvňujú centrá, je zahrnuté poškodenie DNA a teplo (napríklad tie, ktoré utrpeli febrilné bunky pacientov). Poškodenie DNA začína dráhy opravy DNA, ktoré môžu ovplyvniť funkciu centier a zloženia proteínov.
Stres generovaný teplom spôsobuje modifikáciu štruktúry centiole, narušenie centier a úplná inaktivácia jeho schopnosti tvoriť mikrotubuly, meniť tvorbu mitotického vretena a zabrániť myitóze.
Prerušenie funkcie centier počas horúčky by mohlo byť adaptívnou reakciou na inaktiváciu pólov vretena a zabrániť abnormálnemu deleniu DNA počas mitózy, najmä vzhľadom na potenciálnu dysfunkciu viacerých proteínov po tepelnom denaturácii.
Tiež by mohla poskytnúť bunke, aby obnovila svoju funkčnú skupinu proteínov pred reštartovaním delenia buniek.
Ďalším dôsledkom inaktivácie centrovania počas horúčky je jeho neschopnosť prejsť na jeho organizovanie a zúčastniť sa na vylučovaní cytotoxických vezikúl.
Abnormálny vývoj centriolov
Vývoj Centriolo je proces je dosť zložitý a hoci sa na ňom zúčastňuje séria regulačných proteínov, môžu sa vyskytnúť rôzne typy porúch.
Ak existuje nerovnováha v podiele proteínov, dieťa Centriolo môže byť defektné, jeho geometria sa môže zdeformovať, osi páru sa môžu odchýliť od kolmej, môže sa vyvinúť viac detí, syn centiole môže dosiahnuť celú dĺžku pred časom, pred časom. Alebo sa môžu páry oddelenia oneskoriť.
Môže vám slúžiť: prírodné a sociálne prostredie v uspokojení ľudských potriebAk existuje nesprávna alebo chybná duplikácia centriolov (s geometrickými defektmi a / alebo viacnásobnou duplikáciou), zmení sa replikácia DNA, je prezentovaná chromozomálna nestabilita (CIN).
Podobne aj centrá centier (napríklad zväčšené alebo rozšírené centrovanie) vedú k CIN a podporujú rozvoj viacerých deťov centrais.
Tieto chyby vývoja generujú poškodenie buniek, ktoré môžu dokonca viesť k zhubnému.
Abnormálne centrioly a malígne bunky
Vďaka zásahu regulačných proteínov, keď sa detegujú anomálie pri vývoji centiolov a/alebo centrovania, môžu bunky implementovať sebapoškodzovanie anomálií.
Ak sa však môže dosiahnuť samoopatrenie anomálie, abnormálne centrioly alebo s viacerými deťmi („nadprirodzené centrioly“) môže viesť k vytvoreniu nádorov („tumorigenéza“) alebo bunkovej smrti.
Nadpurné centrioly majú tendenciu sa stretávať, čo vedie k zoskupeniu centier („amplifikácia centier“, charakteristické pre rakovinové bunky), meniace sa bunkovú polaritu a normálny vývoj mitózy, čo vedie k výskytu nádorov.
Bunky s nadprirodzenými centrami sa vyznačujú predstavením nadmerného pericentriolárneho materiálu, prerušením valcovej štruktúry alebo nadmernej dĺžky ne -perpendikulárnych alebo slabo umiestnených centriolov a centriolov.
Bolo navrhnuté, že zhluky centriolov alebo centier v rakovinových bunkách by mohli slúžiť ako „biomarker“ pri používaní terapeutických a imaginologických činidiel, ako sú superparagnetické nanočastice.
Odkazy
- Borisy, G., Heald, r., Howard, J., Janke, C., Musacchio, a., & Nogales a. (2016). Mikrotubuly: 50 rokov po objavení tubulínu. Prírodné prehľady biológie molekulárnych buniek, 17 (5), 322-328.
- Buchwalter, r. Do., Chen, J. Vložka., Zheng a., & Megraw, T. L. Centrá v rozdelení buniek, vývoj a choroby. els.
- Gambarotto, D., & Basto, R. (2016). Predmety číselných centier Defekty vo vývoji a chorobách. V mikrotubulovom cyskelete (str. 117-149). Springer Viedeň.
- Huston, r. L. (2016). Preskúmanie centiole aktivity a neoprávnenej aktivity počas delenia buniek. Pokroky v bioscience a biotechnológii, 7 (03), 169.
- Inaba, k., & Mizuno, K. (2016). Dysfunkcia spermií a ciliopatia. Reprodukčná medicína a biológia, 15 (2), 77-94.
- Keeling, J., Tsiokas, l., & Maskey, D. (2016). Bunkové mechanizmy riadenia ciliárnej dĺžky. Bunky, 5 (1), 6.
- Ubytovňa, h., Berk, a., Kaiser, C. Do., Krieger, m., Bretscher, a., Ploegh, h., Amon, a., Martin, K. C. (2016). Biológia molekulárnych buniek. New York: W. H. Freeman a spoločnosť.
- Matamoros, a. J., & Baas, P. W. (2016). Mikrotubuly pri zdraví a degeneratívnom ochoreniach nervového systému. Bulletin Research Brain, 126, 217-225.
- Pellegrini, L., Wetzel, a., Grannó, s., Heaton, G., & Harvey, K. (2016). Späť do tubulu: dynamika mikrotubulov pri Parkinsonovej chorobe. Bunkové a molekulárne vedy o živote, 1-26.
- Scheer, u. (2014). Historické korene výskumu centier: Objav Boveriho mikroskopu sklíčka vo Würzburgu. Phil. Previesť. R. SOC. B, 369 (1650), 20130469.

