Štruktúra karbidu vápenatého (CAC2), vlastnosti, získanie, použitia

- 724
- 4
- Tomáš Klapka
On Karbid vápenatý Je to anorganická zlúčenina tvorená prvkami vápnika (Ca) a uhlíka (C) (C). Jeho chemický vzorec je CAC2. Je to tuhá látka, ktorá môže byť bezfarebná až žltkasto alebo šedo biela a dokonca čierna v závislosti od nečistôt, ktoré obsahuje.
Jedna z jeho najdôležitejších chemických reakcií CAC2 je ten, ktorý sa vyskytuje pri vode h2Alebo, v ktorej forma acetylénu HC≡CH. Preto sa používa na priemyselne získanie acetylénu. V dôsledku tej istej reakcie na vodu sa používa na dozrievanie ovocia, vo falošných delách a v námorných svetle.
 Karbid vápnika CAC2 tuhý. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons.
Karbid vápnika CAC2 tuhý. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons. Reakcia CAC2 S vodou tiež vytvára užitočné bahno na prípravu clinkera (zložka cementu), ktoré produkuje menej oxidu uhličitého (CO2) V porovnaní s tradičnou metódou výroby cementu.
S dusíkom (n2) Karbid vápenatý tvoria kyanamid vápnika, ktorý sa používa ako hnojivo. CAC2 Používa sa tiež na odstránenie síry z určitých zliatin kovu.
Pred nejakým časom CAC2 Používa sa v So -called karbidových žiarovkách, ale tieto už nie sú príliš bežné, pretože sú nebezpečné.
[TOC]
Štruktúra
Karbid vápenatý je iónová zlúčenina a je tvorená CACICIO ION2+ a karbid alebo acetyluro c22-. Karbidový ión sa skladá z dvoch atómov uhlíka spojených s trojitým dlhopisom.
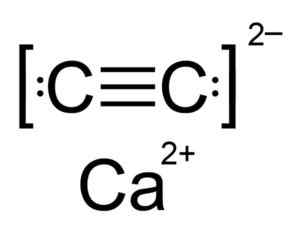 Chemická štruktúra karbidu vápnika. Autor: Hellbus. Zdroj: Wikimedia Commons.
Chemická štruktúra karbidu vápnika. Autor: Hellbus. Zdroj: Wikimedia Commons. Kryštalická štruktúra CAC2 Je odvodený od kubického (ako je chlorid sodný naCl), ale ako ión C22- Štruktúra je predĺžená, je zdeformovaná a otočí tetragonálne.
Menovanie
- Karbid vápenatý
- Karbid vápenatý
- Vápenatá acetylu
Vlastnosti
Fyzický stav
Kryštalická tuhá látka, že keď je čistá bezfarebná, ale ak je kontaminovaná inými zlúčeninami, môže byť žltkastý alebo šedá až čierna.
 Karbid vápnika CAC2 S nečistotami. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Karbid vápnika CAC2 S nečistotami. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Molekulová hmotnosť
64 0992 g/mol
Môže vám slúžiť: Alilo: alyická jednotka, karbocation, radikálne, príkladyBod topenia
2160 ° C
Bod varu
CAC2 Varty pri 2300 ° C s rozkladom. Bod varu by sa mal merať pri inertnej atmosfére, to znamená bez kyslíka alebo vlhkosti.
Hustota
2,22 g/cm3
Chemické vlastnosti
Karbid vápenatý reaguje s vodou za vzniku acetylénu HC≡CH a CA -CACIL Hydroxid (OH)2:
Kac2 + 2 h2O → HC≡CH + CA (OH)2
Acetylén je horľavý, a preto v prítomnosti vlhkosti CAC2 Môže to byť horľavé. Avšak, keď je suchý, nie je to.
 Karbid vápnika CAC2 S vodou HC≡CH acetylénovej forme, horľavá zlúčenina. Kristina Kravets/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Karbid vápnika CAC2 S vodou HC≡CH acetylénovej forme, horľavá zlúčenina. Kristina Kravets/CC By-S (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Karbid vápenatý reaguje s dusíkom N2 Na vytvorenie kyanamidu CACN Calcio2:
Kac2 + N2 → CACN2 + C
Získanie
Karbid vápenatý sa vyrába priemyselne v elektrickej oblúkovej peci na základe zmesi uhličitanu vápenatého (Caco3) a uhlie c), ktoré sa predkladajú pri teplote 2000 ° C. Reakcia je zhrnutá takto:
Zlodej3 + 3 C → CAC2 + Co ↑ + co2↑
Alebo tiež:
CAO + 3 C → CAC2 + Co ↑
V elektrickej oblúkovej rúre je elektrický oblúk medzi dvoma grafitovými elektródami, ktoré odolávajú vysokým vytvoreným teplotám. Získa sa karbid vápenatý s 80-85% čistota.
Žiadosti
Pri výrobe acetylénu
Priemyselne sa používa reakcia karbidu vápenatého s vodou na výrobu acetylénu C2H2.
Kac2 + 2 h2O → HC≡CH + CA (OH)2
Toto je najdôležitejšie použitie karbidu vápnika. V niektorých krajinách je acetylén vysoko ocenený, pretože umožňuje produkovať polyvinylchlorid, ktorý je typom plastu. Okrem toho acetylén slúži na vykonávanie zvarov pri vysokých teplotách.
 HC≡CH acetylénový plameň kovov pri veľmi vysokých teplotách. Autor: Shutterbug75. Zdroj: Pixabay.
HC≡CH acetylénový plameň kovov pri veľmi vysokých teplotách. Autor: Shutterbug75. Zdroj: Pixabay. Pri znižovaní emisií CO2
Zvyšky získané zo získania acetylénu začínajúce z CAC2 (Tiež sa nazývajú „kal karbidu vápenatého“ alebo „zvyšky karbidu vápenatého“) slúžia na použitie pri získavaní cllinku alebo betónu.
Môže vám slúžiť: technologické aplikácie elektronických emisií atómovBahno z karbidu vápenatého má vysoký obsah hydroxidu vápenatého (CA (OH)2) (asi 90%), nejaký uhličitan vápenatý (CACO3) a má pH viac ako 12.
 Zvyšky karbidu vápenatého sa môžu použiť v stavebnej aktivite na prípravu betónu, čím sa zníži generovanie CO2 uvedeného priemyslu. Autor: Engin Akyurt. Zdroj: Pixabay.
Zvyšky karbidu vápenatého sa môžu použiť v stavebnej aktivite na prípravu betónu, čím sa zníži generovanie CO2 uvedeného priemyslu. Autor: Engin Akyurt. Zdroj: Pixabay. Z týchto dôvodov môžete so SIO reagovať2 alebo al2Ani3 tvorba produktu podobného produktu získaného procesom hydratácie cementu.
Jedna z ľudských aktivít, ktorá produkuje najviac spoločných emisií2 Je to stavebný priemysel. CO2 Počas reakcie sa vytvára na východ od uhličitanu vápenatého za vzniku betónu.
Použitie vápenatého karbidu na nahradenie uhličitanu vápenatého (CACO3) Zistilo sa, že ko -emisie sa znižujú2 V 39%.
Pri získavaní kyanamidu vápenatého
Karbid vápenatý sa tiež používa priemyselne na získanie CACN kyanamidu vápenatého2.
Kac2 + N2 → CACN2 + C
Kyanamid vápenatý sa používa ako hnojivo, pretože s pôdnou vodou sa stáva kyanamidom h2n = c = n, čo poskytuje dusík rastlinám, čo je nevyhnutná živina pre tieto.
V metalurgickom priemysle
Karbid vápenatý sa používa na odstránenie zliatin, ako je Ferroníquel. CAC je zmiešaný2 S roztavenou zliatinou pri 1550 ° C. Síra (S) reaguje s karbidom vápenatého a sulfidom vápenatého a uhlia C:
Kac2 + S → 2 C + CAS
Odstránenie síry je uprednostňované, ak je miešanie efektívne a obsah uhlíka v zliatine je nízky. Sulfid vápenatý kasclium pláva na povrchu roztavenej zliatiny, kde sa zvolí a vyhodí.
Na niekoľkých použitiach
Karbid vápenatý sa použil pri odstraňovaní síry železa. Tiež ako palivo pri výrobe ocele a ako výkonný deoxidant.
Môže vám slúžiť: aromatická elektrofilná substitúcia: mechanizmus a príkladyPoužíva sa na dozrievanie ovocia. Z karbidu vápenatého s vodou sa generuje acetylén, ktorý indukuje dozrievanie ovocia, ako sú banány.
 Banány môžu dozrieť pomocou karbidu vápnika CAC2. Autor: Fotografie Alexas. Zdroj: Pixabay.
Banány môžu dozrieť pomocou karbidu vápnika CAC2. Autor: Fotografie Alexas. Zdroj: Pixabay. Karbid vápenatý sa používa vo falošných delách na spôsobenie hlasného výbuchového hluku, ktorý ich charakterizuje. Tu sa používa aj tvorba acetylénu, ktorá exploduje s iskrom v artefakte.
CAC2 Používa sa na generovanie signálov na šírom mori v námorných svetlá.
Prerušené použitie
CAC2 Používa sa v So -Called Carbide Lights. Ich prevádzka spočíva v kvapkaní vody na karbidu vápenatého za vzniku acetylénu, ktorý sa zapne, a tak poskytuje svetlo.
Tieto žiarovky sa použili v uhoľných baniach, ale ich použitie bolo prerušené v dôsledku prítomnosti metánového plynu Cho4 V týchto baniach. Tento plyn je horľavý a plameň lampy z karbidu ho môže spôsobiť oheň alebo využívať.
 CAC vápniková karbidová žiarovka2. Doména Scehardt / Pub. Zdroj: Wikimedia Commons.
CAC vápniková karbidová žiarovka2. Doména Scehardt / Pub. Zdroj: Wikimedia Commons. Boli široko používané v bridlicových skalných baniach, medi a plechovke a tiež v prvých autách, motocykloch a bicykloch, ako sú predné svetlá alebo svetlomety.
Momentálne boli nahradené elektrickými lampami alebo dokonca LED žiarovkami. Stále sa však používajú v krajinách ako Bolívia, v strieborných baniach Potosí.
Riziká
Karbid vápnika CAC2 suchý nie je horľavý, ale v prítomnosti acetylénu vlhkosti, čo je.
Hasiť oheň v prítomnosti CAC2 Voda, pena, oxid uhličitý alebo hasiace prístroje by sa nikdy nemali používať. Mal by sa používať hydroxid sodný alebo vápenatý.
Odkazy
- Ropp, r.C. (2013). Skupina 14 (C, SI, GE, SN a PB) Zlúčeniny alkalických zemín. Vápenaté karbidy. V encyklopédii alkalických Zemech Zeme. Zotavené z vedeckých pracovníkov.com.
- Pohanish, r. P. (2017). C. Vápnik karbidu. V Sittigovej príručke toxických a nebezpečných chemikálií a karcinagenov (siedme vydanie). Zotavené z vedeckých pracovníkov.com.
- Slnko, h. a kol. (2015). Vlastnosti chemicky vloženého resue karbidu vápenatého a jeho inteligencie k cementovým vlastnostiam. Materiály 2015, 8, 638-651. NCBI sa zotavila.NLM.NIH.Vláda.
- Nie, Z. (2016). Ekologické materiály a hodnotenie životného cyklu. Prípadová štúdia: CO2 Emisia analýza kalku karbidu vápenatého. V zelenej a udržateľnej výrobe pokročilého materiálu. Zotavené z vedeckých pracovníkov.com.
- Crundwell, f.Klimatizovať. A kol. (2011). Rafinácia ferronickul. Odstránenie síry. V extrakčnej metalurgii kovov niklu, kobaltu a platiny. Zotavené z vedeckých pracovníkov.com.
- Tressler, r.A. (2001). Štrukturálna a termmostrukturálna keramika. Karbidy. V encyklopédii materiálových vedy a techniky. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.

