Štruktúra uhličitanu zinku (ZnCO3), vlastnosti, použitie

- 4863
- 1539
- Blažej Hrmo
On zinkový uhličitan Je to anorganická zlúčenina tvorená prvkami zinočnatého (Zn), uhlíka (C) a kyslíka (O) (O). Jeho chemický vzorec je Znco3. Zinok má oxidačný stav +2, uhlíka +4 a kyslík -2.
Je to bezfarebná alebo biela pevná látka, ktorá sa nachádza v prírode, ktorá tvorí minerál Smithsonit, v ktorom môže byť sám alebo s inými prvkami, ako je kobalt alebo meď, ktoré mu dodávajú fialové alebo zelené sfarbenie.
 Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-ccy-SA-3.0/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-ccy-SA-3.0/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Znco3 Je takmer nerozpustný vo vode, ale ľahko sa rozpustí v zriedených kyselinách, ako uhličitanový ión v kyslom uhlíkovom tvare (H2Co3), ktorý sa potom stáva plynovým plynom2 a voda.
Používa sa ako antiseptikum v ranách zvierat a niekedy sa dodáva v strave, aby sa predišlo chorobám spôsobeným nedostatkom zinku.
Slúži na oneskorenie spálených, že určité vlákna, plasty a ďasná, keď prídu do kontaktu s ohňom. Umožňuje bezpečne oddeliť toxické minerály arzénu od iných hornín.
Používa sa v denníkových pastoch na obnovenie dentínu v zuboch pri bielení.
[TOC]
Štruktúra
Znco3 Je tvorená katiónom Zn2+ a anión Co32-. Uhlík v uhličitanom ióne má oxidačný stav +4. Tento ión má plochú štruktúru s tromi atómami kyslíka obklopujúce atóm uhlíka.
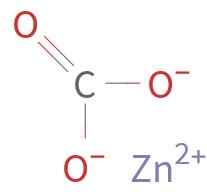 Chemická štruktúra uhličitanu zinku. Neznámy autor / verejná doména. Zdroj: Wikimedia Commons.
Chemická štruktúra uhličitanu zinku. Neznámy autor / verejná doména. Zdroj: Wikimedia Commons. Menovanie
- Zinkový uhličitan
- Monokarbonát zinku
- Zinočnatá soľ kyseliny uhličitám
- Smithsonita
- Zinok
Vlastnosti
Fyzický stav
Bezfarebná pevná alebo kryštalická biela. Rímske kryštály.
 Zinkový uhličitan. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons.
Zinkový uhličitan. Ondřej mangl / krčma doména. Zdroj: Wikimedia Commons. Molekulová hmotnosť
125,4 g/mol
Bod topenia
Pri 140 ° C sa rozkladá bez topenia.
Hustota
4 398 g/cm3 pri 20 ° C.
Rozpustnosť
Prakticky nerozpustné vo vode: 0,000091 g/100 g h2Alebo pri 20 ° C. Rozpustné v zriedených kyselinách, zásadách a amónnych soli. Nerozpustný v amoniaku, alkoholu a acetóne.
Chemické vlastnosti
Reaguje s kyselinami tvoriacimi oxid uhličitý:
Znco3 + 2 h+ → Zn2+ + H2Alebo + co2↑
Rozpúšťa sa v základoch tvoriacich hydroxid, ktorý sa čiastočne rozpustí a vytvára ión zincato:
Môže vám slúžiť: Bromín: História, štruktúra, elektronická konfigurácia, vlastnosti, použitieZnco3 + 2 oh- → Zn (OH)2 + Co32-
Zn (oh)2 + H2Alebo + oh- → [Zn (OH)3(H2Buď)]-
Nie je to horľavé. Keď sa zahrieva na rozklad, produkuje oxid zinočnatý a oxid uhličitý, ale môže emitovať oxid uhoľnatý (CO).
Znco3 + Teplo → ZnO + Co2↑
Získanie
Získava sa minerál Smithsonitu, predtým nazývaný zincova šatka.
Môže sa tiež pripraviť zmiešaním roztoku uhličitanu sodného so zinkovou soľou, ako je síran zinočnatý. Sulfát sodný zostáva rozpustený a uhličitany zinočnatého zinku:
Znso4 + Nat2Co3 → Znco3↓ + NA2SW4
Žiadosti
Pri lekárskych ošetreniach
Táto zlúčenina vám umožňuje získať niektoré farmaceutické výrobky. Používa sa na zapálenú pokožku vo forme prachu alebo mlieka.
Vo veterinárnych aplikáciách
Znco3 Slúži ako adstringent, antiseptický a lokálny ochranca zvierat u zvierat.
Umožňuje tiež zabrániť chorobám spôsobeným nedostatkom zinku, takže sa používa ako doplnok v strave niektorých zvierat, za predpokladu, že podané množstvá sú v rámci noriem stanovených zdravotníckymi agentúrami.
 Uhličitan zinok sa niekedy podáva ako mikroživín, aby sa zabránilo chorobám u ošípaných. Neznámy autor / CC0. Zdroj: Wikimedia Commons.
Uhličitan zinok sa niekedy podáva ako mikroživín, aby sa zabránilo chorobám u ošípaných. Neznámy autor / CC0. Zdroj: Wikimedia Commons. Pri vypuknutí porcheratózy u ošípaných sa pridáva do stravy z nich. Toto ochorenie je zmena kože, v ktorej nie je správne formovaná vrstva rohovky.
Ako spomaľovač horenia
Používa sa ako ohnivá náplň pre gumy a plasty, ktoré sú vystavené vysokým teplotám. Umožňuje chrániť textilné vlákna pred ohňom.
V prípade bavlnených textílií sa aplikuje na tkaninu spolu s niektorými alkali. To priamo útočí na primárne hydroxylové skupiny (-ch2OH) celulózy a robí z nich sodiocelulóza (-ch2Ona).
Ruptúra celulózových väzieb alkali uprednostňuje väčšiu prienik za kompaktnú celulózovú štruktúru, takže viac množstva ZnCO3 dokáže vstúpiť do amorfnej zóny tohto a jej disperzia je uľahčená.
Môže vám slúžiť: Vanadium: História, vlastnosti, štruktúra, použitie Niektoré bavlnené tkaniny môžu obsahovať Znco3 vo svojich vláknach, aby boli odolné voči ohňu. Ponožka.JPEG: Scott Bauererivatívna práca: Sock / Public Domain. Zdroj: Wikimedia Commons.
Niektoré bavlnené tkaniny môžu obsahovať Znco3 vo svojich vláknach, aby boli odolné voči ohňu. Ponožka.JPEG: Scott Bauererivatívna práca: Sock / Public Domain. Zdroj: Wikimedia Commons. V dôsledku toho sa zníži množstvo horľavého plynu, ktorý by sa mohol vyskytnúť pri požiari.
V zubnej liečbe
Určité dentifrické krémy založené na nanokryštáloch uhličitanu zinku a hydroxyapatitu sa pravidelne aplikujú na zubné protézy, znižuje sa precitlivenosť účinnejšie ako krvácania na základe fluoridu.
Nanokryštály Znco3 a hydroxiapatit má veľkosť, tvar, chemické zloženie a kryštalinitu podobnú ako z dentínu, takže zubné tubuly môžu byť uzavreté aplikáciou týchto materiálov.
 Nanočastice Znco3-Hydroxiapathit bol úspešne testovaný, aby sa znížila citlivosť v bielených zuboch. Autor: Foto mix. Zdroj: Pixabay.
Nanočastice Znco3-Hydroxiapathit bol úspešne testovaný, aby sa znížila citlivosť v bielených zuboch. Autor: Foto mix. Zdroj: Pixabay. Tento typ dentifrických pastov bol užitočný po procesoch bielenia zubov.
Na oddelenie nebezpečných minerálov arzénov
Arzénové minerálne metódy síry (ako je Galena, chalkopyrit a pyrit) sa testovali pomocou ZnCO)3. Ruda v arzéne musí byť oddelená od ostatných, pretože tento prvok je veľmi toxický a jedovatý znečisťujúci prostriedok pre živé bytosti.
Aby sa to dosiahlo, zmes mletých hornín sa ošetrí roztokom síranu zinočnatého a uhličitanu sodný na pH 7,5 až 9,0 a xantátovú zlúčeninu.
 Arzenopirita. Tento minerál by sa mal oddeliť od ostatných, pretože obsahuje toxický arzén. Oddelenie je možné dosiahnuť pomocou zinočnatého uhličitanu. James St. John/CC od (https: // creativeCommons.Org/licencie/BY/2.0). Zdroj: Wikimedia Commons.
Arzenopirita. Tento minerál by sa mal oddeliť od ostatných, pretože obsahuje toxický arzén. Oddelenie je možné dosiahnuť pomocou zinočnatého uhličitanu. James St. John/CC od (https: // creativeCommons.Org/licencie/BY/2.0). Zdroj: Wikimedia Commons. Účinnosť vzorca sa pripisuje tvorbe malých častíc ZnCO3 Na povrchu arzenopyritu, ktorý ho robí hydrofilnou (súvisí s vodou), takže nemôžete priľnúť do vzduchových bublín a nemôžete sa vznášať, vyzrážať sa a oddeľovať sa od ostatných minerálov.
Pri získavaní ďalších zlúčenín zinku
Uhličitan zinok sa použil na získanie hydrofóbnych nanoštruktúr bóra vzorca 3Zno • 3B2Ani3• 3,5 hodiny2Ani. Tento materiál sa môže použiť ako aditívna spomaľovacia hoň v polyméroch, dreve a textíliách.
Pri zotavovaní zinku zvyškových odpadových vôd
Bohaté syntetické vody na zinkových iónoch zlikvidovaných elektrodepozičnými procesmi sa môžu ošetrovať technológiou fluidizovanej postele pomocou uhličitanu sodného na zrážanie ZNCO3.
Môže vám slúžiť: sekundárny alkohol: Čo je, štruktúra, vlastnosti, použitiaKeď Zn zráža2+ Vo forme uhličitanu znižuje jeho koncentráciu, získaná tuhá látka je filtrovaná a vody sa môžu bezpečne vyradiť. Znco3 zrazenina je vysoká čistota.
Ostatné aplikácie
Umožňuje pripraviť ďalšie zlúčeniny zinku. Používa sa v kozmetike. Podáva sa ako pigment a používa sa na výrobu porcelánu, keramiky a hrnčiarstva.
Riziká
Inhalácia prachu Znco3 Môže to spôsobiť rozhodnutie, kašeľ, hrudník, horúčku a nepohodlie potu. Jeho požitie produkuje nevoľnosť a zvracanie.
Účinky na životné prostredie
Hlavným rizikom je jeho vplyv na životné prostredie, preto by sa malo vyhnúť tomu, aby sa v tomto rozptýlilo. Je veľmi toxický pre vodný život s dôsledkami, ktoré trvajú v živých organizmoch.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Zinkový uhličitan. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Sharma, V. a kol. (2018). Syntéza nanonedlov uhličitanov zinku, na potenciálne spomalenie horenia pre bavlnené textílie. Celulóza 25, 6191-6205 (2018). Odkaz obnovený.Prubár.com.
- Guan a. a kol. (2020). Koloidný ZnCO3 ako silný depresívny arzenopyrit v slabo alkalickej buničine a mechanizmus interakcie. Minerály 2020, 10, 315. MDPI sa zotavila.com.
- Choroby pokožky, oka, spojivky a vonkajšieho ucha. (2017). Vo veterinárnej medicíne (jedenáste vydanie). Zotavené z vedeckých pracovníkov.com.
- Hannig, m. a Hannig, C. (2013). Nanobiomateriály v preventívnom stomatológii. V nanobiomateriáloch v klinickom stomatológii. Kapitola 8. Zotavené z vedeckých pracovníkov.com.
- Tugrul, n. a kol. (2015). Syntéza hydrofóbnych nanoštruktúr zinočnat. Res Chem Intermediate (2015) 41: 4395-4403. Odkaz obnovený.Prubár.com.
- Luna, m.D.G., a kol. (2020). Zotavenie zinkových granúl zo syntetickej elektroplatovej odpadovej vody pomocou homogénneho kryštalizačného procesu fluidizovaného. Int. J. Prostredie. Sci. Technológia. 17, 129-142 (2020). Odkaz obnovený.Prubár.com.

