Uhličitan sodný (NA2CO3)
- 1450
- 398
- Alfréd Blaho
Vysvetľujeme, čo je uhličitan sodný, jeho fyzikálne a chemické vlastnosti, štruktúra a aplikácie
 Štruktúra uhličitanu sodného a vzorca
Štruktúra uhličitanu sodného a vzorca Čo je uhličitan sodný?
On uhličitan sodný (Na2Co3) Je to anorganická soľ, alkalický kov a kyselina uhličitá. Je tiež známy na celom svete ako Sosa Ash. Jazerá a sopečné aktivity obohatili pôdy sodíka, z ktorých boli rastliny vyživované; Potom, po požiari, tieto rastliny šíria uhličitan popol.
Ako vzniká táto kovová sodná soľ? Čistý sodík má konfiguráciu Valencia [NE] 3S1. Orbitálny elektrón 3S1 Ľahko sa oddeľuje inými prvkami prírody (ako je síra, kyslík, chlór, fluór atď.), formovanie minerálnych zlúčenín, na ktorých sa zúčastňuje stabilný ión NA+.
Potom+ V týchto tuhých látkach sú sprevádzané inými iónovými druhmi; Z toho je uhličitan sodný iba v prítomnosti iba v prírode. Odvtedy sa v celej dobe využíval vo všetkých civilizáciách. Tieto civilizácie zistili, že sivé prachové prospešné vlastnosti pre svoje domovy a ľudí.
Tieto vlastnosti znamenali ich použitie, ktoré dnes zachovávajú tradičné aspekty minulosti a ďalšie vyhovujú súčasným potrebám.
Uhličitan sodný je veľmi hojný a možno aj na iných územiach mimo planéty Zem, ako napríklad niektoré mesiace slnečnej sústavy.
Vzorec
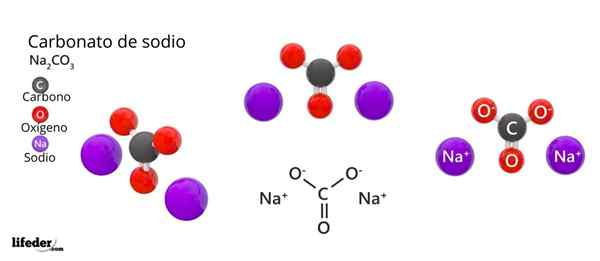
Chemický vzorec uhličitanu sodného je NA2Co3. Ako sa interpretuje? To znamená, že v kryštalickej pevnej látke pre každú ko -iónu32- Existujú dva ióny+.
Uhličitan sodný
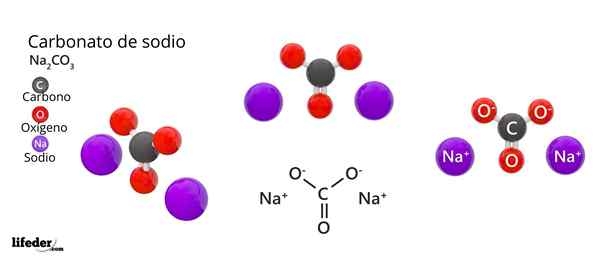
Na hornom obrázku je reprezentovaná štruktúra NA2Co3 Anhydrid (tiež nazývaný Sosa Calcinada). Fialové gule zodpovedajú iónom NA+, zatiaľ čo čierna a červená pre ióny CO32-.
Uhličitanové ióny majú plochú trigonálnu štruktúru s atómami kyslíka na svojich vrcholoch.
Môže vám slúžiť: kyselina kocová: štruktúra, vlastnosti, získanie, použitieObrázok poskytuje panorámu videnú z vyššej roviny. Ióny+ Sú obklopení šiestimi atómami kyslíka, z CO -ions32-. To znamená v NA2Co3 Anhydrid Sodík sa stretáva s oktaedrickou koordinačnou geometriou (je uzamknutý v strede oktaedronu).
Táto štruktúra je však tiež schopná ubytovať molekuly vody, interagujúca s vodíkovými mostmi s vrcholmi trojuholníkov.
V skutočnosti NA hydraty2Co3 (Na2Co3· 10h2Alebo, na2Co3· 7h2Alebo, na2Co3· H2Alebo a ďalšie) majú väčšiu hojnosť ako slaná soľ.
Termonatrit (na2Co3· H2O), natron (na2Co3· 10h2O) a trona (na3(HCO3) (Co3) · 2h2Alebo sú hlavnými prírodnými zdrojmi uhličitanu sodného, najmä minerálu Trona, reprezentované na prvom obrázku.
Použitie/aplikácie uhličitanu sodného
Uhličitan sodný plní početné funkcie u ľudí, domácností a priemyslu, medzi týmito funkciami Vynikujú:
- Uhličitan sodný sa používa v mnohých čistiacich výrobkoch. Dôvodom je jeho dezinfekčná kapacita, jej sila rozpúšťať tuky a ich majetok na zmäkčenie vody. Je súčasťou detergentov používaných v práčovni, automatickej umývačke riadu, čisté sklo, miešanie škvŕn, bielidlá atď.
- Dezinfekčný prostriedok uhličitanu sa môže používať na tvrdých povrchoch, ako sú podlahy, steny, porcelán a vane, s výnimkou Laminá a hliník, ktorý ho môže poškriabať.
- Používa sa v niektorých potravinách, aby sa predišlo skrine, ktorá sa môže vyskytnúť v týchto.
- Je prítomný v niekoľkých výrobkoch osobnej starostlivosti, ako sú bublinové kúpele, zubné cestoviny a mydlá.
- Používa sa v sklenenom priemysle kvôli svojej schopnosti rozkladať silikáty.
- Používa sa na údržbu bazénov, kde plní dezinfekčný a regulačný funkcia pH.
- U ľudí terapeuticky používané pri liečbe kyslosti a dermatitídy.
- Vo veterinárnej medicíne sa používa pri liečbe červenia kruhu a čistenia pokožky.
Syntéza uhličitanu sodného

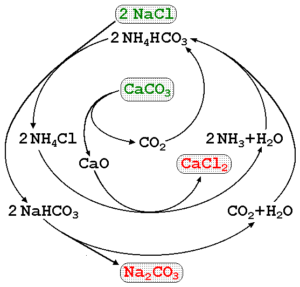
Uhličitan sodný sa môže vyrábať pomocou soľanky moria a vápenca (Caco3) V procese solvay. Na vynikajúcom obrázku je zobrazený procesný diagram a poukazuje na výrobné trasy, ako aj reagenty, sprostredkovateľov a produkty. Reagencie sú napísané zelenými písmenami a výrobkami s červenými písmenami.
Monitorovanie týchto reakcií môže byť trochu zložité, ale globálna rovnica, ktorá naznačuje iba činidlá a produkty, je:
2NACL (aq) + caco3(s) na2Co3(s) + CACL2(Ac)
Caco3 Má veľmi stabilnú kryštalickú štruktúru, takže neustále vyžaduje veľa energie, aby ju rozložil v CO2. Tento proces okrem toho vytvára veľké množstvo CACL2 (chlorid vápenatého) a ďalšie nečistoty, ktorých výboje ovplyvňujú kvalitu vody a životného prostredia.
Existujú aj ďalšie metódy výroby uhličitanu sodného v priemyselných oblastiach, ako sú procesy Hou a LeBlanc.
Dnes je jeho získanie z prírodných minerálov udržateľné, Trona je z nich najhojnejšia.
Na druhej strane, najtradičnejšia metóda pozostávala z kultivácie a pálenia rastlín a rias bohatých na sodík. Potom sa popol kúpal vodou a podrobil sa zahrievaniu až do produktu. Odtiaľto sa objavilo Sosin Soosin Ashes.
Vlastnosti uhličitanu sodného
Potom2Co3 Je to hygroskopická biela tuhá látka, toaleta s molekulovou hmotnosťou 106 g/mol a hustotou 2,54 g/ml pri 25 ° C.
Jeho vlastnosti sa menia ako molekula vody začleňuje do svojej kryštalickej štruktúry. Pretože voda môže tvoriť vodíkové mosty a ióny „otvorené priestory“ medzi nimi, objem skla sa zvyšuje a hustota hydrátu klesá. Napríklad pre NA2Co3· 10h2Alebo, jeho hustota je 1,46 g/ml.
Môže vám slúžiť: RETVERNA REAKCIA: Charakteristiky a príkladyPotom2Co3 Roztopí sa pri 851 ° C, rozklad podľa nasledujúcej rovnice:
Nat2Co3(s) => na2Alebo (s) + co2g)
Opäť, napriek CO iónom32- a na+ Líšia sa vo veľkostiach, ich elektrostatické interakcie sú veľmi účinné a udržiavajú stabilnú kryštalickú sieť.
Molekuly vody „bránia“ tieto interakcie a v dôsledku toho sú hydráty náchylnejšie na rozklad ako anhydrid.
Je to základná soľ; to znamená rozpustený vo vode, vytvára roztok s pH väčším ako 7. Je to kvôli hydrolýze CO32-, Koho reakcia vydáva Oh- v strede:
Co32-(Ac) + h2Alebo (l) HCO3-(Ac) + OH-(Ac)
Je veľmi rozpustný vo vode a polárnych rozpúšťadlách, ako je glycerol, glycerín, acetón, acetát a tekutý amoniak.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. V prvkoch skupiny 1. (Štvrté vydanie., p. 265). MC Graw Hill.
- Scifun.orgán. (2018). Uhličitan s sodným a uhličitan sodný. Zotavené z Scifun.orgán
- Wikipedia. (2018). Uhličitan sodný. Získaný z.Wikipedia.orgán
- Publikácia. (2018). Uhličitan sodný. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda
- Ciner Resources Corporation. (2018). Popolček. Ciner sa zotavil.my.com
- Peltier K. (3. júla 2018). Všetko, čo potrebujete vedieť o karbonite sodný. Získané 8. apríla 2018, od: Thespruce.com
- Priemysel. (2018). Uhličitan sodný - Použitie uhličitanu sodného. Získané 8. apríla 2018, od: Science.šarvák.orgán

