Karbonát z uhličitanu draselného (K2CO3), vlastnosti, použitia, získanie

- 4622
- 1159
- Tomáš Klapka
On Uhličitan draselný Je to anorganická zlúčenina tvorená dvoma iónmi draslíka k+ a uhoľný ión32-. Jeho chemický vzorec je K2Co3. Je to hygroskopická biela tuhá látka, to znamená, že ľahko absorbuje vodu z prostredia. Preto sa v laboratóriách používa na absorbovanie vody z iných látok.
Je veľmi rozpustný vo vode tvoriacej alkalické roztoky, ktoré sú bohaté na OH ióny-a preto s vysokou hodnotou pH. Jeho vodné roztoky, pretože sú alkalické, sa používajú v niekoľkých priemyselných procesoch na absorbovanie kyslých plynov, ako je oxid uhličitý2 a sulfid vodíka h2S, potom ich ľahko neutralizuje.
 Uhličitan draselný k2Co3 tuhý. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons.
Uhličitan draselný k2Co3 tuhý. Ondřej Mangl [verejná doména]. Zdroj: Wikimedia Commons. K2Co3 Používa sa na prípravu mydiel, čistiacich výrobkov, čistiacich prostriedkov na umývanie oblečenia a zmesí na umývanie riadu. Používa sa tiež pri spracovaní niektorých textilných vlákien, ako je vlna.
Všeobecne sa používa v chemických laboratóriách, napríklad na absorbovanie vody z iných zlúčenín alebo na alkalizácie zmesí chemických reakcií a tiež v chemickej analýze.
Pridá sa tiež do niektorých potravín, napríklad na odstránenie horkej chuti semien kakaa počas výroby čokolády.
[TOC]
Štruktúra
Uhličitan draselný sa skladá z dvoch katiónov draselných K+ a uhličitan anión32-. Anión uhličitanu má plochú a symetrickú štruktúru, zatiaľ čo tri atómy kyslíka obklopujú uhlík tvoriaci plochý trojuholník.
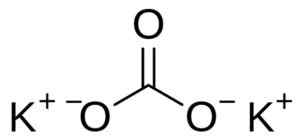 Štruktúra uhličitanu draselného K2Co3. Používateľ: EDGAR181 [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra uhličitanu draselného K2Co3. Používateľ: EDGAR181 [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Uhličitan draselný
- Uhličitan draselný
- Uhličitan dipotázy
- Potaš
- Draselná soľ kyseliny uhličitám.
Vlastnosti
Fyzický stav
Kryštalické pevné bezfarebné až biele.
Molekulová hmotnosť
138,205 g/mol.
Bod topenia
899 ° C.
Bod varu
Rozkladá sa.
Hustota
2,29 g/cm3
Rozpustnosť
Veľmi rozpustné vo vode: 111 g/100 g vody pri 25 ° C. Nerozpustný v etanole a acetóne.
Môže vám slúžiť: Príspevky z chémie do medicínypH
Vodný roztok môže mať pH 11,6, to znamená, že je celkom zásadité.
Chemické vlastnosti
Uhličitan draselný je delikátny alebo hygroskopický, to znamená, že absorbuje vlhkosť životného prostredia. Má stabilný hydrát, K2Co3.2h2Ani.
K2Co3 Vo vodnom roztoku je hydrolyzovaný, to znamená, že reaguje s vodou uvoľňovaním OH skupín- ktoré sú tí, ktorí dodávajú riešenia zásadnosť:
Co32- + H2Alebo ⇔ Oh- + HCO3-
HCO3- + H2Alebo ⇔ Oh- + H2Co3
Získanie
Je možné získať od zostávajúceho popola pri spaľovaní rastlín. Tiež karbonáciou hydroxidu draselného KOH, to znamená pridanie prebytočného oxidu uhličitého2 Koh:
Koh + co2 → KHCO3
2 khco3 + Teplo → k2Co3 + H2Ani
Ďalším spôsobom, ako ho získať, je zahrievanie chloridu draselného KCL s uhličitanom horečnatý3, voda2 pod tlakom. Najprv sa získa dvojitý hydratovaný horčík a draslík a draslík3.Khco3.4H2Alebo sa nazýva Engels Salt:
2 kcl + 3 mgco3 + Co2 + 5 h2O → Mgco3.Khco3.4H2Alebo ↓ + mgcl2
Dvojitá hydratovaná soľ Engels sa vyzráža a oddeľuje od roztoku filtráciou. Potom sa uhličitan draselný automobil zahrieva a vytvorí2Co3 že pridaním vody sa rozpustí, zatiaľ čo MGCO horčík uhličitan3 zostáva nerozpustný a eliminovaný filtráciou.
Mgco3.Khco3.4H2O + teplo → mgco3↓ + 2 K+ + Co32- + Co2↑ + 9 h2Ani
Žiadosti
V absorpcii CO2 V priemyselných procesoch
Roztok uhličitanu draselného je klasickým ošetrením odstraňovania oxidu uhličitého CO2 V rôznych procesoch, najmä vo vysokých tlakoch a aplikáciách teploty.
 K riešenia2Co3 Používajú sa na absorpciu CO2 V rôznych priemyselných procesoch. Autor: Nicola Giordano. Zdroj: Pixabay.
K riešenia2Co3 Používajú sa na absorpciu CO2 V rôznych priemyselných procesoch. Autor: Nicola Giordano. Zdroj: Pixabay. Odstránenie CO2 vyskytuje sa podľa nasledujúcej reakcie:
Klimatizovať2Co3 + Co2 + H2Alebo 2 khco3
Táto metóda sa používa napríklad na liečbu zemného plynu. Aj v rastlinách na výrobu energie, aby sa predišlo emisii CO2 do atmosféry a pri výrobe suchého ľadu.
Môže vám slúžiť: Hydroxid medený (ii): Štruktúra, vlastnosti, nomenklatúra, použitia K riešenia2Co3 Používajú sa na získanie CO2 ktorý slúži na výrobu suchého ľadu. ProjectManhattan [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
K riešenia2Co3 Používajú sa na získanie CO2 ktorý slúži na výrobu suchého ľadu. ProjectManhattan [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. K -rozvoja2Co3 Môže byť tepelne regenerovaná, to znamená, že sa teploty zahrievajú okolo 100 ° C.
Aby sa roztok uhličitanu draselného absorboval CO2 pri dobrej rýchlosti, pridávajú sa promótory, ktoré urýchľujú proces, ako je dietanolamín (DEA).
Pri odstraňovaní H2S určitými procesmi
Roztoky uhličitanu draselného sa tiež používajú na odstránenie plynného sulfidu vodíka H2S procesnými prúdmi. Niekedy sa pridá draselný tiffosfát k3Po4 pre rýchlejšie, čo je proces.
V chemickom laboratóriách
K2Co3 Umožňuje napríklad organickú syntézu, napríklad v kondenzačných reakciách a neutralizácii. Slúži na odstránenie vody z organických tekutín ako dehydratačný alebo vysušený činidlo v laboratóriu.
Používa sa tiež v reakciách analytickej chémie a na alkalizáciu vo farmaceutickom priemysle.
V priemysle čistiaceho výrobku
K2Co3 Používa sa na výrobu mydla, čistenie vzorcov, výrobkov na oblečenie a pranie jedál a tiež na prípravu šampónu a iných výrobkov pre osobnú starostlivosť.
 K2Co3 Používa sa v príprave mydla. Lacrosus [verejná doména]. Zdroj: Wikimedia Commons.
K2Co3 Používa sa v príprave mydla. Lacrosus [verejná doména]. Zdroj: Wikimedia Commons. V potravinárskom priemysle
Uhličitan draselný sa pridáva do rôznych potravín s niekoľkými účelmi.
Napríklad sa pridáva do semien kakaa, aby sa odstránila ich horká chuť a používa ich do výroby čokolády. Pridá sa do hrozna v procese sušenia, aby sa získalo hrozno hrozna.
 Kakaové semená sú ošetrené K2Co3 Na zníženie jeho horkej chuti pri výrobe čokolády. Autor: Magali Couret. Zdroj: Pixabay.
Kakaové semená sú ošetrené K2Co3 Na zníženie jeho horkej chuti pri výrobe čokolády. Autor: Magali Couret. Zdroj: Pixabay. V obchode s pečivom sa používa ako leudant (pôsobiaci ako droždie) múky na prípravu pečených potravín.
Môže vám slúžiť: Lutecio: Štruktúra, vlastnosti, použitie, získanie K2Co3 Môže sa použiť ako ledant v koláčoch, pretože keď vydáva CO2 Počas varenia tieto zvýšenie objemu. Autor: Pixel1. Zdroj: Pixabay.com
K2Co3 Môže sa použiť ako ledant v koláčoch, pretože keď vydáva CO2 Počas varenia tieto zvýšenie objemu. Autor: Pixel1. Zdroj: Pixabay.com V hnojivách
K2Co3 Používa sa na oplodnenie kyslých pôd, ako uhoľná ión32- V kontakte s vodou produkuje oh ióny- ktoré zvyšujú pH pôdy. Okrem draslíka K+ Je to výživa pre rastliny.
Uhličitan draselný sa tiež používa na výrobu pomalých hnojív.
Pomaly uvoľňovanie hnojív alebo uvoľnené živiny, aby sa nerozpustili a ťahali vodou. Vďaka tomu môžu tráviť viac času k dispozícii pre korene rastlín.
V niekoľkých aplikáciách
Uhličitan draselný k2Co3 Používa sa tiež pre:
- Sušenie, bielené a čisté procesy čistenia vlny a ďalšie činnosti v oblasti textilného priemyslu
- Získanie ďalších organických a anorganických draslíkových solí, ako je KCN Draselný kyanid.
- Fungujte ako regulátor kyslosti v rôznych procesoch.
- Robiť keramiku a keramiku.
- Procesy rytia a litografie.
- Opálenie.
- Pripravte si tlačové atramenty, pigmenty.
- Hrebeň2Co3 Je kompatibilnejší ako uhličitan sodný na sodný2Co3 S oxidmi olova, bária a stroncia, ktoré tieto sklo obsahujú.
- Úprava vody.
- Oneskorenie požiaru (vo forme vodných roztokov).
- Inhibovať koróziu a ako antivírovací agent v procesných tímoch.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Uhličitan draselný. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Steele, D. (1966). Chémia kovových prvkov. Pergamon Press Ltd. Londýn.
- Mokhatab, s. a kol. (2019). Ošetrenie zemného plynu. Roztok uhličitanu draselného. V príručke prenosu a spracovania zemného plynu (štvrté vydanie). Zotavené z vedeckých pracovníkov.com.
- Kakaras, e. a kol. (2012). Tlakové fluidné spaľovanie postele (PFBC) Kombinované cyklotrasy. Tlakové fluidné spaľovanie postele so zachytením a skladovaním uhlíka. V systémoch kombinovaných cyklov pre generovanie energie takmer nulovej energie. Zotavené z vedeckých pracovníkov.com.
- Speight, J.G. (2019). Výroba vodíka. Mokrý. Pri vymáhaní a modernizácii ťažkej ropy. Zotavené z vedeckých pracovníkov.com.
- Branan, C.R. (2005). Ošetrenie plynu: Kapitola aktualizovaná Chrisom Higmanom. Horúci uhličitan. V pravidlách pre chemických inžinierov (štvrté vydanie). Zotavené z vedeckých pracovníkov.com.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. VCH Verlagsgellschaft MBH.
- Li, a. a Cheng, f. (2016). Syntéza nového hnojiva s pomalým uvoľňovaním draselného z modifikovanej pidgeónovej horčíkovej trosky pomocou uhličitanu draselného. J Air Waste Management Assoc, 2016 Aug; 66 (8): 758-67. NCBI sa zotavila.NLM.NIH.Vláda.

