Uhličitan amónny (NH4) 2CO3)
- 5089
- 1532
- Denis Škriniar
Čo je uhličitan amónny?
On Uhličitan amónny Je to anorganická dusíkatá soľ, konkrétne amoniakálny, ktorej chemický vzorec je (NH4)2Co3. Je rozpracovaný metód syntézy, medzi ktorými stojí za použitie sublimácie zmesi síranu amónneho a uhličitanu vápenatého: (NH4)2SW4(s)+ Caco3(s) => (nh4)2Co3(s)+ prípad4(S).
Všeobecne sa v nádobe zahrievajú amónne soli a uhličitan vápenatý, aby spôsobili uhličitan amónny. Priemyselná metóda, ktorá produkuje tony tejto soli, je prejsť oxid uhličitým cez absorpčný stĺpec, ktorý obsahuje roztok amonia vo vode, a potom vykonáva destiláciu.
Výpary obsahujúce amónny, oxid uhličitý a voda sa kondenzujú za vzniku kryštálov uhličitanu amónneho: 2NH3g)+ h2Alebo (l) + co2g) → (NH4)2Co3(S). V reakcii sa vyskytuje kyselina uhličitá, h2Co3, Po rozpustení oxidu uhličitého vo vode a je to táto kyselina, ktorá poskytuje svoje dva protóny, h+, na dve molekuly amoniaku.
Vlastnosti uhličitanu amónneho
 Vzhľad uhličitanu amónneho
Vzhľad uhličitanu amónneho Je to biela, kryštalická a bezfarebná pevná látka so silnými vôňami a príchuťami amoniaku. Roztavuje sa na 58 °.
Tento rozklad sa však vyskytuje v dvoch krokoch: Prvá sa uvoľní molekula NH3, produkujúce hydrogenuhličitan amónny (NH4HCO3); A po druhé, ak zahrievanie pokračuje, uhličitan je disproporcia.
Je to pevné rozpustné vo vode a menej rozpustné v alkoholoch. Vytvorte vodíkové mostíky s vodou a keď sa 5 gramov rozpustí v 100 gramoch vody, vytvára základný roztok s pH okolo 8,6.
Môže vám slúžiť: emulgátor: proces emulzie, molekulárne aspekty, aplikácieJeho vysoká afinita k vode je vyrobená hygroskopickou tuhou látkou (absorbuje vlhkosť), a preto je ťažké ju nájsť vo svojej forme siete. V skutočnosti jeho monohydrátová forma (NH4)2Co3· H2O), je najbežnejším zo všetkých a vysvetľuje, ako je soľ nosičom plynu amoniaku, čo spôsobuje vôňu.
Vo vzduchu sa rozkladá, aby vytvoril hydrogenuhličitan amónny a uhličitan amónny (NH4NH2Co2).
Chemická štruktúra
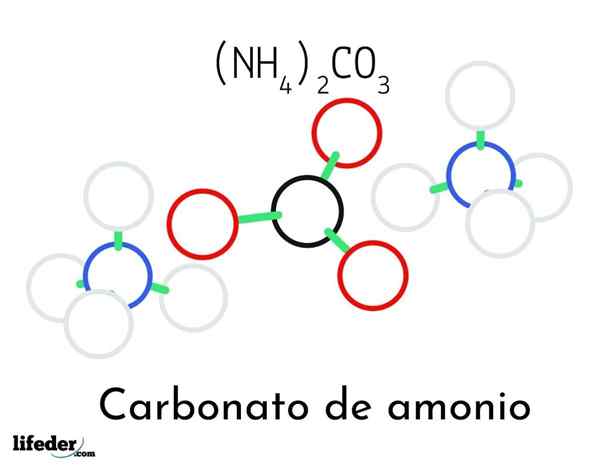
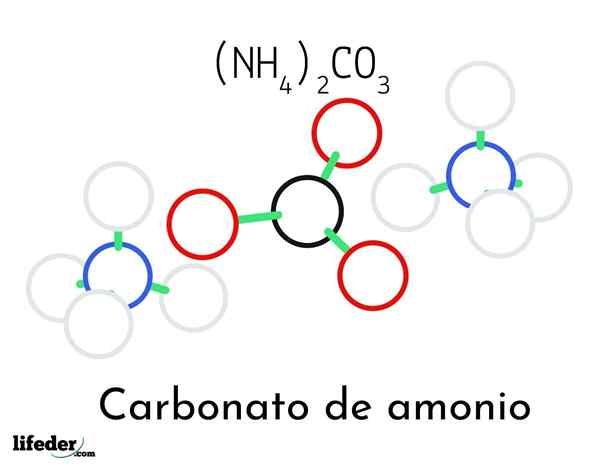
 Model štruktúry uhličitanu amónneho; Dva amoniak a jedno karbonátové katióny
Model štruktúry uhličitanu amónneho; Dva amoniak a jedno karbonátové katióny Na vynikajúcom obraze je ilustrovaná chemická štruktúra uhličitanu amónneho. Uprostred je anión Co32-, plochý trojuholník s čiernym stredom a červené gule; A na dve strany, katióny Ammonios NH4+ s tetraedrálnymi geometriami.
Geometria amónnych iónov je vysvetlená hybridizáciou SP3 atómu dusíka, objednávanie atómov vodíka (biele gule) okolo neho vo forme tetraedronu. Medzi tromi iónmi sú stanovené vodíkovými mostmi (h3N-h- o-Co22-).
Vďaka svojej geometrii, jednej spoločnej spoločnosti32- môže tvoriť až tri vodíkové mosty; zatiaľ čo NH katióny4+ Možno nemôžu tvoriť svoje zodpovedajúce štyri vodíkové mosty kvôli elektrostatickým odporom medzi ich pozitívnymi nábojmi.
Výsledkom všetkých týchto interakcií je kryštalizácia ortorbického systému. Prečo je to také hygroskopické a vo vode rozpustné? Odpoveď je v rovnakom predchádzajúcom odseku: vodíkové mosty.
Tieto interakcie sú zodpovedné za rýchlu absorpciu vody anhydridnej soli (NH4)2Co3· H2Buď). To má za následok zmeny v priestorovom usporiadaní iónov, a teda v kryštalickej štruktúre.
Môže vám slúžiť: nikel chlorid (NICL2): Štruktúra, vlastnosti, získanie, použitiaŠtrukturálne zvedavosť
Bez ohľadu na to, ako jednoduché (NH vyzerá4)2Co3, Je tak citlivý na nespočetné transformácie, že jej štruktúra je záhadou predložená skutočnému zloženiu tuhých. Táto štruktúra sa tiež líši v závislosti od tlakov, ktoré ovplyvňujú kryštály.
Niektorí autori zistili, že ióny sú usporiadané ako koplanály lemované vodíkovými mostmi (to znamená reťazec so sekvenciou NH4+-Co32--…) V ktorých molekulách vody pravdepodobne slúžia ako konektory s inými reťazcami.
Ešte viac, presahovanie pozemskej oblohy, ako sú tieto kryštály v priestorových alebo medzihviezdnych podmienkach? Aké sú vaše kompozície z hľadiska stability sýtených druhov? Existujú štúdie, ktoré potvrdzujú veľkú stabilitu týchto kryštálov uväznených v planétových a kométských ľadových masách.
To im umožňuje slúžiť ako uhlíkové, dusíkové a vodíkové rezervy, ktoré sa môžu pri prijímaní slnečného žiarenia transformovať na organický materiál, ako sú aminokyseliny.
To znamená, že tieto amoniakálne bloky zmrzliny môžu byť nosičmi „kolesa, ktoré začína strojové zariadenie života“ vo vesmíre. Z týchto dôvodov sa ich záujem v oblasti astrobiológie a biochémie zvyšuje.
Použitie/aplikácie
Používa sa ako leuers, pretože zahrievanie produkuje oxid uhličitý a plyny amónny. Uhličitan amónny je, ak chcete, predchodcom moderného prášku na pečenie a môže sa použiť na pečenie cookies a plochých sušienok.
Jeho použitie na pečenie koláčov sa však neodporúča. V dôsledku hrúbky koláčov sa vo vnútri zachovávajú amónne plyny a vytvárajú nepríjemnú chuť.
Môže vám slúžiť: cyklohexen: štruktúra, vlastnosti, syntéza a použitiaPoužíva sa ako expektorant, to znamená, že pri deformácii Bronchi zmierňuje kašľ. Má fungicídne akcie, z tohto dôvodu v poľnohospodárstve. Je tiež regulátorom kyslosti prítomnej v potravinách a používa sa v syntéze organickej močoviny pri vysokých tlakoch a Hidantoinas.
Riziká
Uhličitan amónny je vysoko toxický. U ľudí produkuje akútne podráždenie ústnej dutiny pri kontakte.
Okrem toho, ak je požitý, spôsobí podráždenie žalúdka. Podobný účinok sa pozoruje v očiach vystavených uhličitanu amónneho.
Vdýchnutie plynov rozkladu soli, môže dráždiť nos, hrdlo a pľúca, čo spôsobuje kašeľ a dýchacie ťažkosti.
Akútna expozícia psa na amonáte amonátu v dávke 40 mg/kg hmotnosti, spôsobuje zvracanie a hnačky. Najvyššie dávky uhličitanu amónneho (200 mg/kg hmotnosti) sú zvyčajne smrteľné. Poškodenie srdca je indikované ako príčina smrti.
Ak sa zahrieva pri veľmi vysokých teplotách a vo vzduchu obohateného o kyslík, vydáva toxické plyny2.
Odkazy
- Publikácia. (2018). Uhličitan amónny. Získané 25. marca 2018 z Pubchem: Pubchem.Ncbi.NLM.NIH.Vláda
- Portál organickej chémie. ((2009-2018)). Reakcia Bucherer-Bergs. Získané 25. marca 2018 z portálu organickej chémie: www.Organická chémia.orgán
- Wikipedia. (2018). Uhličitan amónny. Získané 25. marca 2018 z Wikipédie: In.Wikipedia.orgán
- Chemická spoločnosť. (2018). Chemická spoločnosť. Získané 25. marca 2018 od Chemical Company: Thechemco.com