Hliníková štruktúra uhličitanu, vlastnosti, použitie
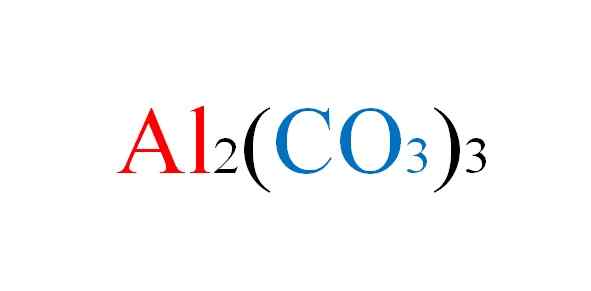
- 2156
- 68
- Mgr. Pravoslav Mokroš
On Hliníkový uhličitan Je to anorganická soľ, ktorej chemický vzorec je2(CO3)3. Je to prakticky neexistujúci kovový uhličitan, vzhľadom na jeho vysokú nestabilitu v normálnych podmienkach.
Medzi dôvodmi jej nestability môžeme spomenúť slabé elektrostatické interakcie medzi iónmi do3+ a co32-, ktoré by teoreticky mali byť veľmi silné pre veľkosti ich zaťaženia.
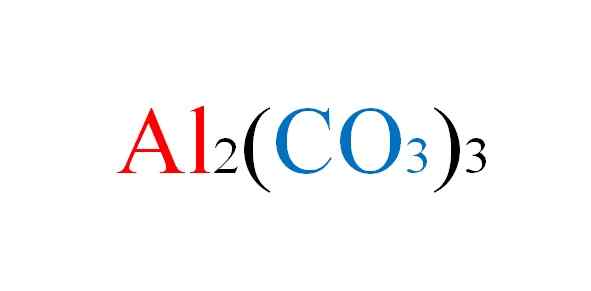 Hliníkový uhličitan. Zdroj: Gabriel Bolívar.
Hliníkový uhličitan. Zdroj: Gabriel Bolívar. Soľ čelí akémukoľvek nepríjemnostiam v papieri, keď sú napísané chemické rovnice ich reakcií; Ale v praxi je to proti tomu.
Napriek tomu, čo bolo povedané, uhličitan z hliníka sa môže vyskytnúť v spoločnosti iných iónov, ako je to v prípade minerálu Dawsonite. Existuje tiež derivát, v ktorom interaguje s vodným amoniakom. Zvyšku sa považuje za zmes medzi Al (OH)3 a h2Co3; čo sa rovná šumivému roztoku s bielym zrazeninou.
Táto zmes má liečivé použitie. Avšak na čistú, izolovateľnú a manipulovateľnú soľ al2(CO3)3, Nie ste známi možné aplikácie; Aspoň nie nízky obrovský tlak alebo extrémne podmienky.
[TOC]
Hliníková uhličitanová štruktúra
Kryštalická štruktúra pre túto soľ nie je známa, pretože je tak nestabilná, že ju nebolo možné charakterizovať. Z jeho vzorca do2(CO3)3, Je však známe, že podiel iónov k3+ a co32- Je 2: 3; to znamená, že pre každé dve katióny pre2+ Musia existovať tri anióny32- Interakcia s nimi elektrostaticky.
Problém je v tom, že oba ióny sú veľmi nerovnaké, pokiaľ ide o ich veľkosti; al3+ Je veľmi malý, zatiaľ čo CO32- Je to objemné. Tento rozdiel už sám o sebe ovplyvňuje stabilitu sietnice kryštalickej siete, ktorej ióny by interagovali „trápne“, ak je táto soľ v tuhom stave izolovaná.
Môže vám slúžiť: Avogadro číslo: História, jednotky, ako sa vypočíta, používaOkrem tohto aspektu, Al3+ Je to vysoko polarizujúci katión, vlastnosť, ktorá deformuje elektronický oblak CO32-. Je to, akoby ho chcel prinútiť, aby kovalentne prepojil, aj keď to anión nemôže urobiť.
V dôsledku toho iónové interakcie medzi Al3+ a co32- Majú tendenciu k kovalencii; Ďalší faktor, ktorý zvyšuje nestabilitu Al2(CO3)3.
Hydroxid uhličitan hliníkový amónny
Chaotický vzťah medzi Al3+ a co32- Zjemňuje vzhľad, keď sú v skle prítomné ďalšie ióny; ako NH4+ a oh-, Z roztoku amoniaku. Tento kvartet iónov k3+, Co32-, NH4+ a oh-, Podarí sa im definovať stabilné kryštály, dokonca schopné prijať rôzne morfológie.
Ďalší príklad podobný tomu je pozorovaný v minerále Dawsonite a jeho orhorrombických kryštáloch, Naalco3(Oh)2, Kde na+ vymeniť NH4+. V týchto soli sú ich iónové väzby dostatočne silné, takže voda nepodporuje uvoľňovanie CO2; alebo aspoň nie náhle.
Aj keď NH4Al (oh)2Co3 (AACC, pre svoje signály v angličtine) ani naalco3(Oh)2 Predstavujú hliníkový uhličitan, môžu sa považovať za základné deriváty toho istého.
Vlastnosti
Molárna hmota
233,98 g/mol.
Nestabilita
V predchádzajúcej časti bolo vysvetlené z molekulárneho hľadiska, prečo Al2(CO3)3 Je to nestabilné. Ale akú transformáciu trpí? Musíte zvážiť dve situácie: jedna suchá a druhá „mokrá“.
Suchý
V suchej situácii anion Co32- CO je obrátený2 prostredníctvom nasledujúceho rozkladu:
Do2(CO3)3 => Al2Ani3 + 3co2
Môže vám slúžiť: fosforečnan vápenatý (CA3 (PO4) 2)Čo dáva zmysel, ak je syntetizovaný pod hlinitou na veľké tlaky CO2; To znamená, že spätná reakcia:
Do2Ani3 + 3co2 => Al2(CO3)3
Preto, aby sa predišlo rozloženiu Al2(CO3)3 Museli by ste predložiť soľ na veľké tlaky (pomocou n2, Napríklad). Týmto spôsobom tvorba CO2 Nebolo by termodynamicky uprednostňované.
Vlhký
Zatiaľ čo vo vlhkej situácii, CO32- Trpí hydrolýzou, ktorá vytvára malé množstvá OH-; Ale dosť na to, aby sa hydroxid hliníka zrážal, na (OH)3:
Co32- + H2Alebo HCO3- + Oh-
Do3+ + 3OH- Al (oh)3
A na druhej strane, Al3+ Je tiež hydrolyzovaný:
Do3+ + H2Alebo (oh)22+ + H+
Aj keď by to bolo skutočne hydratované3+ Na vytvorenie komplexu (h2Buď)63+, ktorý je hydrolyzovaný, aby sa dal [h (h2Buď)5Oh]2+ a h3Ani+. Potom h3Alebo (alebo h+) Protona to Co32- do h2Co3, ktorý sa rozpadá na CO2 a h2Buď:
Co32- + 2h+ => H2Co3
H2Co3 Co2 + H2Ani
Všimnite si, že nakoniec AL3+ Správa sa ako kyselina (uvoľnite h+) a základňa (uvoľniť oh- S rovnováhou rozpustnosti AL (OH)3); to znamená, že vykazuje amfoterizmus.
Fyzický
Aby sa dokázala izolovať, táto soľ bude pravdepodobne biela, rovnako ako mnoho iných hliníkových solí. Tiež z dôvodu rozdielu medzi iónovými rádiámi Al3+ a co32-, Určite by to malo v porovnaní s inými iónovými zlúčeninami veľmi nízke teploty topenia alebo varu.
Môže vám slúžiť: Benchilo: benzylové hydrogény, karbocations, benzylové radikályA pokiaľ ide o jeho rozpustnosť, bol by nekonečne rozpustný vo vode. Okrem toho by to bol hygroskopický a chutný tuhý. Sú to však iba dohady. Ďalšie vlastnosti by sa museli odhadnúť s výpočtovými modelmi, ktoré sú predmetom vysokých tlakov.
Žiadosti
Aplikácie, ktoré sú známe z uhličitanu z hliníka, sú lekárske. Používa sa ako mäkký astringent a ako liek na liečbu zápalu a žalúdočného vredu. Používa sa tiež na zabránenie tvorby močových výpočtov u ľudí.
Používa sa na kontrolu zvýšenia obsahu tela vo fosforečnanom a tiež na liečbu symptómov kyslosti žalúdka, kyslého trávenia a vredov žalúdka.
Odkazy
- Xuehui l., Zhe t., Jongming c., Ruiyu z. & Chenguang L. (2012). Hydrotermálna syntéza nanoplateletov hydroxidu uhličitanu amónneho hliniaka (AACH) a nanovlákna. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Amónny hliník Hliník hydroxid hydroxidu NH4AL (OH) 2CO3. Powder Technology, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Národné centrum pre biotechnologické informácie. (2019). Hliníkový uhličitan. Databáza pubchem., CID = 1035396. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2019). Hliníkový uhličitan. Zdroj: In.Wikipedia.orgán
- Hliníkový. (2019). Hliníkový uhličitan. Získaný z: hlinítko.slepo

