Reakčné teplo
- 2817
- 443
- MUDr. Žigmund Boška
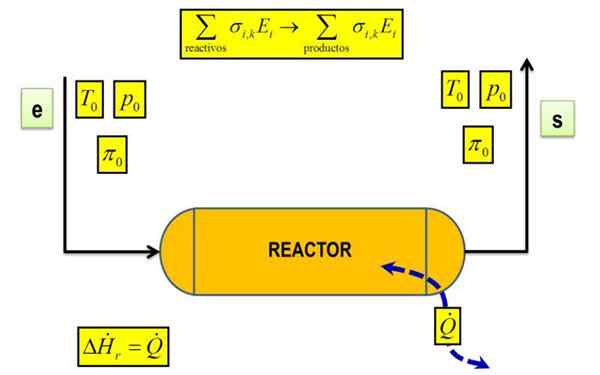
 Reakčná tepelná schéma za určitých podmienok teploty a tlaku. Zdroj: Joseasorrentino, CC BY-SA 4.0, Wikimedia Commons
Reakčná tepelná schéma za určitých podmienok teploty a tlaku. Zdroj: Joseasorrentino, CC BY-SA 4.0, Wikimedia Commons Čo je reakčné teplo?
On reakčné teplo, o Entalpia reakcie (AH), je množstvo energie na mol, ktoré sa uvoľňuje alebo sa vyrába v chemickej reakcii pri konštantnom tlaku. Je to termodynamická jednotka užitočnej miery na výpočet uvoľnenej alebo vyrobenej energie.
Pretože entalpia odvodzuje z tlaku, objemu a vnútornej energie, ktoré sú funkciami štátu, entalpia je tiež štátnou funkciou.
ΔH alebo zmena entalpie, vznikla ako jednotka merania zameraná na výpočet zmeny energie systému, keď bolo príliš ťažké nájsť AU alebo zmenu vnútornej energie systému, súčasne meranie množstva tepla a vymenená práca.
Poskytnúť.
Notácia ΔHº alebo ΔHºr potom vstaňte vysvetliť presnú teplotu a tlak reakčného tepla ΔH.
Štandardná entalpia reakcie je symbolizovaná pomocou ΔHº alebo AHºRXN a môže predpokladať kladné aj negatívne hodnoty. Jednotky pre ΔHº sú kiložné na mol alebo kj / mol.
Predchádzajúci koncept na pochopenie reakčného tepla: rozdiely medzi AH a AHºr
- Δ = predstavuje zmenu entalpie (entalpia produktov okrem entalpie reaktantov).
Pozitívna hodnota naznačuje, že výrobky majú väčšiu entalpiu alebo že ide o endotermickú reakciu (vyžaduje sa teplo).
Záporná hodnota naznačuje, že reaktanty majú väčšiu entalpiu alebo že ide o exotermickú reakciu (dochádza k tepla).
- ° = znamená, že reakcia je štandardná zmena entalpie a vyskytuje sa pri vopred stanovenom tlaku / teplote.
- R = označuje, že táto zmena je entalpou reakcie.
Môže vám slúžiť: vápnik: Vlastnosti, štruktúra, získanie, používanie- Štandardný stav: Štandardný stav tuhej látky alebo kvapaliny je čistá látka pri tlaku 1 bar, alebo čo je rovnaká, 1 atmosféra (105 pA) a teplota 25 ° C alebo čo je rovnaké, 298 klimatizovať.
- ΔHºr Je to štandardné reakčné teplo alebo štandardná entalpia reakcie a ako AH tiež meria entalpiu reakcie. Avšak AHºRXN sa uskutočňuje v „štandardných“ podmienkach, čo znamená, že reakcia sa uskutočňuje pri 25 ° C a 1 atm.
Výhoda merania AH za štandardných podmienok spočíva v schopnosti vzťahovať hodnotu AH s inou, pretože sa vyskytujú v rovnakých podmienkach.
Útvary
Štandardné formáčné teplo, ΔHF°, chemikálie je množstvo tepla absorbované alebo uvoľňované z tvorby 1 mol tejto chemikálie pri 25 ° C a 1 bar prvkov v jeho štandardných stavoch.
Prvok je vo svojom štandardnom stave, ak je vo svojej najstabilnejšej forme a fyzickej podmienke (pevná látka, kvapalina alebo plyn) pri 25 ° C a 1 bar.
Napríklad štandardné teplo tvorby oxidu uhličitého znamená kyslík a uhlík ako činidlá.
Kyslík je stabilnejší ako molekuly plynu alebo2, zatiaľ čo uhlík je stabilnejší ako pevný grafit (grafit je v štandardných podmienkach stabilnejší ako diamant).
Na vyjadrenie definície iným spôsobom je štandardným teplom formovania špeciálny typ štandardného reakčného tepla.
Reakcia je tvorba 1 mol chemikálie jej prvkov vo svojich štandardných stavoch v štandardných podmienkach.
Môže vám slúžiť: kovový charakterŠtandardné teplo formácie sa tiež nazýva štandardná entalpia formácie (hoci v skutočnosti ide o zmenu entalpie).
Podľa definície by tvorba samotného prvku nepriniesla žiadnu zmenu entalpie, takže štandardné reakčné teplo pre všetky prvky je nula.
Výpočet reakčnej entalpie
1. Experimentálne výpočet
Entalpia sa dá merať experimentálne pomocou kalorimetra. Kalorimeter je prístroj, v ktorom vzorka reaguje prostredníctvom elektrických káblov, ktoré poskytujú aktivačnú energiu. Vzorka sa nachádza v nádobe obklopenej vodou, ktorá je neustále miešaná.
Pri meraní s kalorimetrom zmena teploty, ku ktorej dochádza, keď vzorka reaguje, a pozná špecifické teplo vody a jej hmotnosť, teplo, ktoré uvoľňuje alebo absorbuje reakciu.
V tejto rovnici je to, čo je teplo, CESP je špecifické teplo, v tomto prípade vody, ktorá sa rovná 1 kalórii na gram, M je hmotnosť vody a At je zmena teploty.
Kalorimeter je izolovaný systém, ktorý má konštantný tlak, takže ΔHr= q
2. Teoretická výpočet
Zmena entalpie nezávisí od konkrétnej cesty reakcie, ale iba od úrovne globálnej energie výrobkov a činidiel. Entalpía je funkciou štátu, a ako taká je aditívna.
Na výpočet štandardnej entalpie reakcie môžeme pridať štandardné entalpie tvorby činidiel a odpočítať ju od súčtu entalpií štandardnej tvorby produktu. Matematicky nám to dáva:
Môže vám slúžiť: 6 prírodných ukazovateľov pH a ich vlastnostiΔHr° = σ ΔHF° (produkty) - σ ΔHF° (reaktanty).
Reakcie Entalpies sa zvyčajne vypočítavajú z entalpies tvorby činidiel za normálnych podmienok (1 stĺpový tlak a teplota 25 ° C).
Aby sme vysvetlili tento princíp termodynamiky, vypočítame entalpiu reakcie na spaľovanie metánu (ch4) Podľa vzorca:
Chvály4 (g) + 22 (g) → CO₂ (g) + 2H2O (g)
Na výpočet štandardnej reakčnej entalpie musíme hľadať štandardné vzdelávacie entalpie pre každý z reagencií a produktov zapojených do reakcie.
Normálne sa nachádzajú v dodatku alebo v niekoľkých online tabuľkách. Pre túto reakciu sú údaje, ktoré potrebujeme,:
HFChvály4 (g) = -75 kjoul/mol.
HF° O2 (g) = 0 kjoul/mol.
HF° CO₂ (g) = -394 kjoul/mol.
HF° H₂o (g) = -284 kjoul/mol.
Všimnite si, že pretože je vo svojom štandardnom stave, štandardná entalpia tvorby plynu je 0 kJ / mol.
Ďalej sumarizujeme naše štandardné entalpie školenia. Majte na pamäti, že pretože jednotky sú v KJ / mol, musíme sa vynásobiť stechiometrickými koeficientmi v rovnici vyváženej reakcie.
Σ ΔHF° (produkty) = ΔHF° CO₂ +2 ΔHF° H₂o
Σ ΔHF° (produkty) = -1 (394 kjoul/mol) -2 (284 kjoul/mol) = -962 kjoul/mol
Σ ΔHF° (reaktanty) = ΔHFChvály4 + ΔHF° O2
Σ ΔHF° (reaktanty) = -75 kjoul/mol + 2 (0 kjoul/mol) = -75 kjoul/mol
Teraz nájdeme štandardnú entalpiu reakcie:
ΔHr° = σ ΔHF° (produkty) - σ ΔHF° (reaktanty) = (- 962)- (- 75) =
ΔHr° = - 887KJ / mol.
Odkazy
- Entalpia definície reakcie. Zotavené z Thoughtco.com.
- (S.F.). Štandardná entalpia reakcie. Zotavené z nekonečného.com.

