Hydrogenuhličitan vápenatý

- 4410
- 1379
- MUDr. Žigmund Boška
 Bikarbonát vápenatého je anorganická soľ skupiny hydrogenuhličitanu
Bikarbonát vápenatého je anorganická soľ skupiny hydrogenuhličitanu Čo je to hydrogenuhličitan vápenatý?
On hydrogenuhličitan vápenatý Je to anorganická soľ s chemickým vzorcom CA (HCO3)2. Vychádza z povahy z uhličitanu vápenatého prítomného vo vápencových a minerálnych kameňoch, ako je kalcit.
Bikarbonát vápenatý je rozpustnejší vo vode ako uhličitan vápenatý. Táto vlastnosť umožnila tvorbu krasových systémov vo vápencových horninách a pri štruktúrovaní jaskýň.
Podzemná voda, ktorá prechádza cez trhliny, saturaje v ich posunu oxidu uhličitého (CO2).
Tieto vody eroduje vápencové horniny, ktoré uvoľňujú uhličitan vápenatý (Caco3), že hydrogenuhličitan vápenatý sa vytvorí podľa nasledujúcej reakcie:
Zlodej3(s) +co2g) +h2Alebo (l) => ca (HCO3)2(aq)
Táto reakcia sa vyskytuje v jaskyniach, v ktorých vznikajú veľmi tvrdé vody. Bikarbonát vápenatého nie je v tuhom stave, ale vo vodnom roztoku spolu s CA2+, Hydrogarbonát (HCO3-) a uhličitanový ión (CO32-).
Následne, znížením saturácie oxidu uhličitého vo vode, sa vyskytuje spätná reakcia, to znamená transformácia hydrogenuhličitanu vápenatého na uhličitan vápenatý:
CA (HCO3)2(aq) => co2 g) +h2Alebo (L) +Caco3 (S)
Uhličitan vápenatý je vo vode málo rozpustný, čo spôsobuje, že jeho zrážanie sa vyskytuje ako tuhá látka. Predchádzajúca reakcia je veľmi dôležitá pri tvorbe stalaktitov, stalagmitov a inej hrúbky v jaskyniach.
Tieto skalnaté štruktúry sú tvorené z kvapiek vody, ktoré spadajú zo stropu jaskýň. Caco3 prítomné v kvapkách vody sa kryštalizuje, aby sa vytvorili vyššie uvedené štruktúry.
Skutočnosť, že nenašiel hydrogenuhličitan vápenatý v tuhom stave, bránilo jeho použitiu a v tejto súvislosti našiel niekoľko príkladov.
Štruktúra hydrogenuhličitanu vápenatého
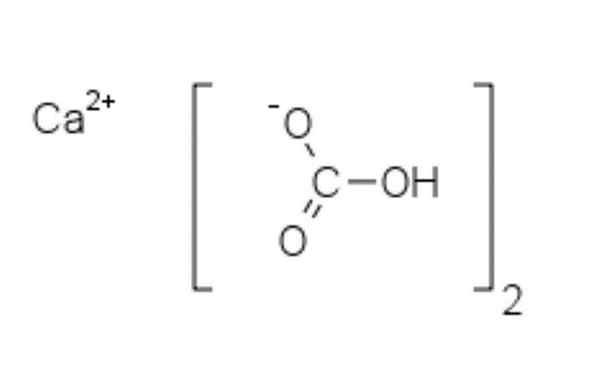 Chemická štruktúra hydrogenuhličitanu vápenatého
Chemická štruktúra hydrogenuhličitanu vápenatého Na hornom obrázku sú zobrazené dva anióny HCO3- a katión2+ elektrostaticky interakcie. CA2+, Podľa obrázka by sa mal nachádzať v strede, pretože tak HCO3- Neodpínali by sa navzájom za svoje negatívne obvinenia.
Záporné zaťaženie v HCO3- Presúva sa medzi dvoma atómami kyslíka, rezonanciou medzi karbonyl c = o skupinou a C-O Link-; zatiaľ čo v CO32-, Toto sa premiestni medzi tromi atómami kyslíka, pretože väzba C-O je nechránená a môže dostať záporné rezonančné zaťaženie.
Môže vám slúžiť: difenylamínGeometrie týchto iónov sa môžu považovať za gule vápnikové obklopené plochými uhličitanovými trojuholníkmi s hydrogenovaným koncom. Pokiaľ ide o pomer veľkosti, vápnik je pozoruhodne menší ako ióny HCO3-.
Vodné roztoky
Hydrogenuhličitan vápenatý Nemôžete tvoriť kryštalické tuhé látky a skutočne sa skladá z vodných roztokov tejto soli. V nich nie sú ióny sami, ako na obrázku, ale obklopené molekulami H2Ani.
Každý ión je obklopený hydratačnou guľou, ktorá bude závisieť od kovu, polarity a štruktúry rozpusteného druhu.
CA2+ Koordinuje sa s atómami kyslíka vody, aby vytvorila akquocomplex, CA (OH2)n2+, kde sa n zvyčajne považuje za šesť; to znamená „vodný oktafedron“ okolo vápnika.
Zatiaľ čo anióny HCO3- Dobre interagujú, buď s vodíkovými mostmi (alebo2Co-h-oh2) alebo s atómami vodíka vody v smere negatívneho zaťaženia (hoco2- H-OH, interakcia dipólu).
Tieto interakcie medzi CA2+, HCO3- A voda je taká účinná, že v tomto rozpúšťadle robí hydrogenuhličitan vápenatý; Na rozdiel od uhličitanu vápenatého (Caco3), v ktorých elektrostatické atrakcie medzi CA2+ A CO32- Sú veľmi silné a vyzrážajú vodný roztok.
Okrem vody existujú aj co -molekuly2 okolo, ktoré reagujú pomaly, aby prispievali viac HCO3- (V závislosti od hodnôt pH).
Hypotetický tuhý
Doteraz veľkosti iónov a zaťaženia v hydrogenuhličitanch vápenatého ani prítomnosť vody vysvetľujú, prečo neexistuje tuhá zlúčenina; to znamená, čisté kryštály, ktoré sa dajú charakterizovať x -ray kryštalografia. Bikarbonát vápenatý nie je nič viac ako ióny prítomné vo vode, z ktorej kavernózne útvary naďalej rastú.
Áno ca2+ a HCO3- Mohli by sa izolovať od vody a vyhnúť sa nasledujúcej chemickej reakcii:
CA (HCO3)2(aq) → Caco3(s) + co2g) + h2Alebo (l)
Potom by sa dali zoskupiť do bielej kryštalickej tuhej látky so stechiometrickými rozmermi 2: 1 (2HCO3/1CA).
Môže vám slúžiť: 30 príkladov chemických suspenziíNeexistujú žiadne štúdie o jej štruktúre, ale dalo by sa porovnávať so štúdiami hydrogenuhličitanu sodného (ako bikarbonát horčíka, MG (HCO3)2, Neexistuje ani ako pevná) alebo s uhličitanom vápenatého.
Stabilita: hydrogenuhličitan sodný (NAHCO3) vs. cminkarbonát vápenatého (CA (HCO3)2)
Kryštalizuje hydrogenuhličitan sodný v monoklinickom systéme a hydrogenuhličitan vápenatý v trigonálnom (kalcite) a orcombických systémoch (aragonit).
Ak sa NA vymení+ pre CA2+, Kryštalická sieť by bola destabilizovaná väčším rozdielom vo veľkostiach; to znamená, na+ Za menší je to, že tvorí stabilnejšie sklo s HCO3- v porovnaní s CA2+.
V skutočnosti CA (HCO3)2(aq) potrebuje vodu, aby sa vyparila, aby jej ióny mohli byť zoskupené do pohára; Ale kryštalická sieť nie je dostatočne silná na to, aby to urobila pri izbovej teplote. Pri zahrievaní vody dochádza k rozkladovej reakcii (rovnica zhora).
Byť iónom na+ V roztoku by to vytvorilo sklo s HCO3- pred jeho tepelným rozkladom.
Dôvodom, prečo hydrogenuhličitan vápenatý nekryštalizuje (teoreticky), je rozdiel iónových rádií alebo veľkostí ich iónov, ktoré pred ich rozkladom nemôžu tvoriť stabilný kryštál.
Cminkarbonát vápenatého (CA (HCO3)2) vs. uhličitan vápenatý (Caco3)
Ak je na druhej strane, pridá sa H+ Do kryštalických štruktúr uhličitanu vápenatého by drasticky zmenili svoje fyzikálne vlastnosti. Možno ich topenie výrazne klesajú a dokonca aj morfológie kryštálov končia modifikované.
Fyzikálne a chemické vlastnosti
Chemický vzorec
CA (HCO3)2
Molekulová hmotnosť
162.11 g/mol
Fyzický stav
Neobjavuje sa v tuhom stave. Nachádza sa vo vodnom roztoku a keď sa aplikuje teplo na odparovanie, stáva sa uhličitan vápenatý.
Rozpustnosť
16,1 g/100 ml pri 0 ° C; 16,6 g/100 ml pri 20 ° C a 18,4 g/100 ml pri 100 ° C.
Tieto hodnoty svedčia o veľkej afinite molekúl vody iónmi hydrogenuhličitanu vápenatého, ako je vysvetlené v predchádzajúcej časti. Medzitým sa v liter vody rozpustí iba 15 mg uhličitanu vápenatého, ktorý odráža jeho silné elektrostatické interakcie.
Pretože hydrogenuhličitan vápenatý nemôže tvoriť pevnú látku, jeho rozpustnosť nemožno experimentálne určiť.
Vzhľadom na podmienky vytvorené CO2 Rozpustená vo vode, ktorá obklopuje vápenec, sa mohla vypočítať hmotnosť vápnika rozpustená pri teplote T; hmotnosť, ktorá by sa rovnala koncentrácii hydrogenuhličitanu vápenatého.
Môže vám slúžiť: kyselina benzyová: syntéza, transpozícia a použitiePri rôznych teplotách sa rozpustená hmota zvyšuje, ako je znázornené v hodnotách pri 0, 20 a 100 ° C. Potom sa podľa týchto experimentov určí, koľko z hydrogenuhličitanu vápenatého Rozpúšťa sa v blízkosti uhličitanu vápenatého vo vodnom médiu splynené CO2.
Akonáhle Co utiekne2 Plynný, uhličitan vápenatý sa zráža, ale nie hydrogenuhličitan vápenatý.
Fúzne a varné body
Krištáľová sieť CA (HCO3)2 Je to omnoho slabšie ako Caco3. Ak by sa dalo získať v tuhom stave a zmerať teplotu, pri ktorej sa topí v rámci zdroja, určite by sa hodnota získala výrazne pod 899 ° C. Podobne by sa to isté malo očakávať pri určovaní bodu varu.
Spaľovací bod
Nie je to palivo.
Riziká
Pretože táto zlúčenina neexistuje pevne, je nepravdepodobné, že predstavuje riziko manipulácie so svojimi vodnými roztokmi, pretože oba ióny CA2+ Ako HCO3- Nie sú škodlivé pre nízke koncentrácie; A preto, najväčšie riziko, ktoré by bolo pri požití takýchto riešení, by mohlo byť spôsobené iba nebezpečnou dávkou požívanou vápnikom.
Ak zlúčenina vytvorila pevnú látku, dokonca aj fyzicky odlišnú od Caco3, Jeho toxické účinky nemohli ísť nad rámec jednoduchého nepohodlia a resekcie po fyzickom kontakte alebo vdýchnutí.
Žiadosti
- Roztoky hydrogenuhličitanu vápenatého sa používajú po dlhú dobu na umývanie starodávnych papierov, najmä umeleckých diel alebo historicky dôležitých dokumentov.
- Na prevenciu osteoporózy sa použili roztoky hydrobonátu. V jednom prípade sa však v jednom prípade pozorovali vedľajšie účinky, ako je hyperkalciémia, metabolická alkalóza a zlyhanie obličiek.
- Bikarbonát vápenatý sa občas podáva intravenózne na korekciu depresívneho účinku hypokaliémie na fungovanie srdca.
- Používa sa na upokojenie kyslosti žalúdka.
Odkazy
- Wikipedia (2018). Hydrogenuhličitan vápenatý. Prevzaté z: v.Wikipedia.orgán
- Sirah Dubois (3. októbra 2017). Čo je to hydrogenuhličitan vápenatý? Získané z: Livestrong.com
- Hub Science Learning Hub (2018). Chémia uhličitanu. Získané z: scientelarn.orgán.nz
- Pubchem (2018). Hydrogenuhličitan vápenatý. Získané z: pubchem.Ncbi.NLM.NIH.Vláda

