História benzénu, štruktúra, vlastnosti, deriváty, použitie

- 4779
- 868
- Valentín Dula
On benzén Je to organická zlúčenina, ktorá pozostáva z jedného z najjednoduchších aromatických uhľovodíkov. Jeho chemický vzorec je C6H6, z ktorých je známe, že vzťah medzi uhlíkom a vodíkom sa rovná 1; to znamená, že pre každý uhlík je s tým vodík spojený.
Aj keď jeho fyzický vzhľad je vzhľad bezfarebnej tekutiny, prirodzene sa nachádza v oleji a výrobkoch odvodených z nej. Jeho vôňa je veľmi charakteristická, pretože pripomína zmes lepidla, bitúmenu a benzínu; Na druhej strane je to prchavá a horľavá kvapalina.
 Belfing benzénom. Zdroj: AIR1404 [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)]
Belfing benzénom. Zdroj: AIR1404 [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)] Na hornom obrázku je zobrazený nádoba alebo fľaša s benzénom, pravdepodobne z neanalytickej čistoty. Ak sú benzénové výpary okamžite odkryté v celom laboratóriu. Z tohto dôvodu sa táto tekutina, bežne používaná ako jednoduché rozpúšťadlo.
Byť tvojím vzorcom c6H6, Chemikálie z 19. storočia zvýšili početné možné štruktúry, ktoré zodpovedajú uvedenému pomeru C/H rovnajúce sa 1. Nielen to, ale molekula benzénu musela mať špeciálne väzby takým spôsobom, aby jej nezvyčajná stabilita mohla byť vysvetlená s pridaným reakciám; Typické pre alkény a politiky.
Bolo to tak, že jeho odkazy predstavovali záhadu pre chemikálie toho času; Kým sa volá majetok aromaticita. Predtým, ako sa považoval za hexacyclotrién (s tromi väzbami C = C), benzén je oveľa viac ako ten a je to ďalší z mnohých príkladov synergie v chémii.
V organickej chémii je benzén klasickým symbolom, štrukturálnym základom pre viacero polylalomatických zlúčenín. Z jeho šesťuholníka sa symfíny derivátov získajú prostredníctvom aromatickej elektrofilnej substitúcie; Prsteň, ktorého okraje hraničia štruktúru, ktorá definuje nové zlúčeniny.
V skutočnosti sú jeho derivátmi dlžné obrovské priemyselné využitie pre tých, ktorí potrebujú benzén medzi ich surovinou. Od prípravy textilného lepidla a vlákien až po plasty, gumy, pigmenty, lieky a výbušniny. Na druhej strane sa prirodzene benzén nachádza v sopkách, lesných požiaroch, benzíne a v dyme cigariet.
[TOC]
História
Objav a mená
Jeho objav sa datuje do roku 1825, zvyčajne udelený Michaelovi Faradayovi, keď zhromaždil a experimenty so zvyšným ropným produktom plynu používaného na osvetlenie. Táto kvapalina obsahovala pomer C/H blízko 1, a preto ju nazýva „karburátorský vodík“.
Chemik Auguste Laurent vymenoval podivný uhľovodík „feno“, odvodený z gréckeho slova “Phaínein„Čo znamená brilantné (pretože bol získaný po spálení plynu). Toto meno však nebolo akceptované vedeckou komunitou a prevládalo iba ako „fenyl“, aby sa označilo radikálne odvodené od benzénu.
Z gumy benzoínu sa chemikovi Eilhardovi Mitscherlichovi o deväť rokov neskôr podarilo produkovať rovnakú zlúčeninu; Preto bol ďalší zdroj pre rovnaký uhľovodík, ktorý pokrstil ako „benzina“. Nezohľadnili však aj vhodné meno za predpokladu, že to bol alkaloid, napríklad chinín.
Nahradili teda meno „Bencina“ „Benzol“. Opäť sa však vyskytli protirečenie a nezrovnalosti, pretože pojem „benzol“ zmätený uhľovodík pre alkohol. To bolo vtedy, keď sa narodilo meno „benzén“, ktoré sa používalo ako prvé vo Francúzsku a Anglicku.
Môže vám slúžiť: uhličitan lítium (LI2CO3): štruktúra, vlastnosti, použitiaPriemyselná produkcia
Ani osvetľujúci plyn, ani benzinová ďasná neboli vhodné zdroje na generovanie benzénu do veľkých mierok. Charles Mansfield, spolupracujúci s augustom Wilhelmom von Hofmann, dosiahnutý v roku 1845 izolujte benzén (dvadsať rokov po objavení) hulla dechtu, laterálny produkt výroby koksu.
Priemyselná výroba benzénu sa tak začala z dechtu Hulla. Dostupnosť benzénu v masívnych množstvách, uľahčila štúdium jeho chemických vlastností a umožnila jej jeho väzbu s inými zlúčeninami podobných reaktivít. August Wilhelm von Hofmann razil slovo „aromatický“ pre benzén a príbuzné zlúčeniny.
Historické štruktúry
Sen augusta Kekulé
Friedrich August Kekulé je ocenený šesťuholníkovou a cyklickou štruktúrou benzénu okolo roku 1865, ktorá vyplýva z podivného sna s Uroborom, hadom, ktorý uhryzne svoj vlastný chvost kreslením kruhu. Veril teda, že benzén možno považovať za hexagonálny kruh a ďalšie chemikálie zvýšené možné štruktúry, ktoré sú uvedené nižšie:
 Benzénové kruhové štruktúry navrhnuté v celej histórii. Zdroj: Jü [verejná doména]
Benzénové kruhové štruktúry navrhnuté v celej histórii. Zdroj: Jü [verejná doména] Niektoré z horných štruktúr by mohli odôvodniť stabilitu benzénu.
Kniha, prstene a hranol
Všimnite si, že tretia štruktúra nie je ani prsteň, ale trojuholníkový hranol, ktorý navrhol Albert Ladenburg v roku 1869; Vľavo, otvorená kniha -v tvare, navrhnutá Sir James Dewar v roku 1867; A napravo, jeden so všetkými hydrogénmi nasmerovanými do stredu kruhu, ktorý navrhol Henry Edward Armstrong v roku 1887.
Prvá štruktúra, ktorú navrhol Adolf Karl Ludwig Claus v roku 1867, je tiež dosť zvláštna, pretože C-C sa prekročia. A posledným bol Kkuléov „Serpentine“ prsteň, sníval v roku 1865.
Aký bol „víťaz“? Piata štruktúra (zľava doprava), navrhla v roku 1899 Johannes Thiele.
V tomto sa prvýkrát zvažoval rezonančný hybrid, ktorý kombinoval dve štruktúry Kekulé (otočil prvý krúžok na pravej strane, aby ho pozoroval) a vysvetlil mimoriadne premiestnenie elektrónov a s ním až do tej doby neobvyklá stabilita benzén.
Benzén
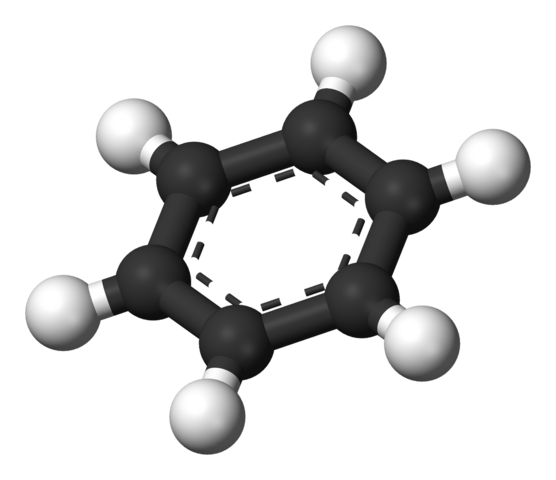 Aromatický prsteň benzénu. Zdroj: Benjah-Bmm27 [verejná doména]
Aromatický prsteň benzénu. Zdroj: Benjah-Bmm27 [verejná doména] Štruktúru navrhnutá Thiele je znázornená pomocou modelu guľôčok a tyčí.
Molekula benzénu je plochá a atómy vodíka ukazujú zo strany kruhu. Všetky atómy uhlíka majú hybridizáciu SP2, S orbitálom p K dispozícii na vytvorenie aromatického systému, v ktorom sa presťahuje šesť elektrónov.
Tieto uhlíky SP2 Sú viac elektronegatívni ako hydrogény, a preto prvá odstráňte elektronickú hustotu na druhú (CSp2Δ--HΔ+). V dôsledku toho má stred prstenca väčšiu koncentráciu elektrónov ako jeho strany.
Presnejšie povedané, aromatický systém môže byť reprezentovaný ako oblak alebo elektronická podložka rozšírená oboma stranami šesťuholníka; a v strede, po stranách alebo okrajoch, elektronický nedostatok tvorený hydrogénmi s pozitívnym čiastočným zaťažením.
Vďaka tomuto rozdeleniu elektrických nábojov môžu benzénové molekuly vzájomne pôsobiť prostredníctvom dipólových dipbolových síl; Atómy HΔ+ Cítia príťažlivosť pre aromatické centrum susedného kruhu (pod tým bude zastúpený).
Podobne môžu byť aromatické centrá naskladané na seba, aby uprednostňovali indukciu okamžitých dipólov.
Môže vám slúžiť: alotropiaRezonancia
 Štruktúry a rezonančný hybrid benzénu. Zdroj: Edgar181 z Wikipédie.
Štruktúry a rezonančný hybrid benzénu. Zdroj: Edgar181 z Wikipédie. Dve Kekulé štruktúry sú zobrazené v hornej časti obrázka a pod nimi je rezonancia hybrid. Keď sa tieto dve štruktúry dejú znova a znova súčasne, hybrid je predstavovaný kruhom nakresleným uprostred (podobne ako „šesťuholníkovej šišky“).
Hybridný kruh je dôležitý, pretože naznačuje aromatický charakter benzénu (a charakter mnohých ďalších zlúčenín). Okrem toho poukazuje na to, že odkazy nie sú také dlhé ako C-C, ani také krátke ako C = C; ale ich dĺžka je medzi oboma koncami. Benzén sa teda nepovažuje za polyhén.
Vyššie uvedené bolo demonštrované meraním dĺžok odkazov C-C (139 pm) benzénu, ktoré sú o niečo pretiahnuté ako väzby C-H (109 pm).
Kryštály
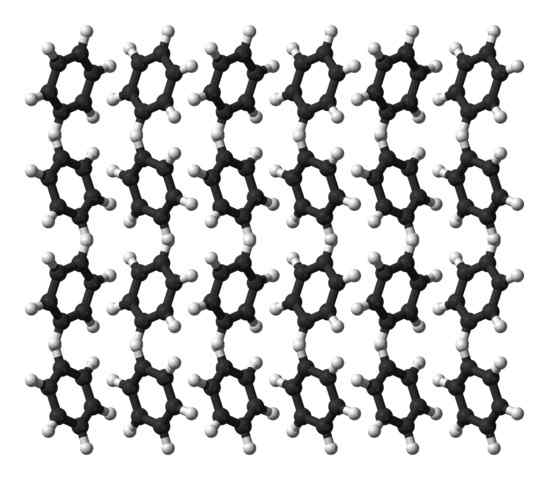 Benzén ortorrombická kryštálová štruktúra. Zdroj: Ben Mills [verejná doména]
Benzén ortorrombická kryštálová štruktúra. Zdroj: Ben Mills [verejná doména] Benzén je kvapalina pri teplote miestnosti. Jeho intermolekulárne sily spôsobujú, že napriek tomu, že takto výrazný dipólový moment dokáže udržať svoje molekuly pohromade v tekutine, ktorá vrie pri 80 ° C. Keď teplota klesne pod 5 ° C, benzén začne zmrznúť: a tak sa získajú zodpovedajúce kryštály.
Benzénové krúžky môžu prijať štrukturálne vzorce definované v ich tuhej farbe. Ich dipóly ich robia „naklonenými“ doľava alebo doprava a vytvárajú rady schopné reprodukovať oratóriou ortorrombickej bunky. Benzénové kryštály sú teda ortorrombické.
V prípade vynikajúceho obrazu si všimnite, že keď sú krúžky naklonené k tomu, aby uprednostňovali interakcie medzi HΔ+ a aromatické centrá, uvedené v predchádzajúcich podsekciách.
Vlastnosti
Molekulárna hmotnosť
78,114 g/mol.
Fyzický vzhľad
Bezfarebná tekutina s vôňou podobnou benzínu.
Bod varu
80 ° C.
Bod topenia
5,5 ° C.
zapaľovač
-11 ° C (zatvorený šálka).
Teplota
497,78 ° C.
Hustota
0,8765 g/ml pri 20 ° C.
Rozpustnosť
Liter vriacej vody môže sotva rozpustiť 3,94 g benzénu. Vďaka jeho apolárnej postave je prakticky nemiešateľný vodou. Je však miešateľný s inými rozpúšťadlami, ako sú etanol, étery, acetón, oleje, chloroform, tetrachlorid uhlíka atď.
Hustota
2.8 vo vzduchu (to znamená takmer trikrát viac).
Tlak vodnej pary
94,8 mm Hg pri 25 ° C.
Spaľovacie teplo
-3267,6 kJ/mol (pre kvapalný benzén).
Odparovanie
33,83 kJ/mol.
Povrchové napätie
28,22 Mn/m A 25 ° C.
Index lomu
1 5011 až 20 ° C.
Deriváty

Benzénové vodíny môžu byť nahradené inými skupinami alebo atómami. Môže existovať jedna alebo viac substitúcií, ktoré zvyšujú stupeň substitúcie, až kým zo šiestich pôvodných vodít existuje.
Napríklad Benceno ako PH-H, kde H je ktorýkoľvek zo svojich šiestich hydrogénov. Pamätajte si, že stred prstenca má väčšiu elektronickú hustotu, priťahuje elektrofily, ktoré zaútočia na kruh, aby nahradil H pri reakcii nazývanej aromatická elektrofilná substitúcia (SEAR).
Ak je tento H nahradený OH, bude mať ph-oh, bude mať fenol; výmena Cho3, PH-CH3, Toluén; Ak je to NH2, PH-NH2, anilín; Alebo ak je to Cho2Chvály3, PH-CH2Chvály3, Etylbenzén.
Deriváty môžu byť rovnaké alebo toxickejšie ako benzén, alebo naopak, stať sa tak zložitými, že sa stanú žiaducim farmakologickým účinkom.
Môže vám slúžiť: karbid vápenatý (CAC2): Štruktúra, vlastnosti, získanie, použitiaŽiadosti
Je to dobré rozpúšťadlo pre širokú škálu zlúčenín, ktoré sú prítomné napríklad v obrazoch, lakoch, lepidlách a povlakoch.
Môže tiež rozpustiť oleje, tuky alebo vosky, takže sa používa ako rozpúšťadlo extraktora esencie. Túto vlastnosť použila Ludwig Roselius v roku 1903 na defeínu kávy, čo je operácia už zneužívaná v dôsledku toxicity benzénu. Podobne sa v minulosti použil na odmasnutie kovov.
V jednom zo svojich klasických použití nefunguje ako rozpúšťadlo, ale ako prísadka: Zvýšte oktán benzínu a na tento účel nahradí olovo.
Deriváty benzénu môžu mať rôzne použitia; Niektoré slúžia ako pesticídy, mazivá, detergenty, plasty, výbušniny, parfumy, farbivá, lepidlo, lieky atď. Ak je vo svojej štruktúre benzénny kruh, je celkom pravdepodobné, že jeho syntéza opustila benzén.
Medzi jeho najdôležitejšie deriváty patrí: Cumeno, xylén, anilín, fenol (pre syntézu fenolových živíc), kyselina benzoová (konzervačný), cyklohexan (pre syntézu nilonu), nitrobenzén, resorcinol a etylbenzén.
Menovanie
Nomenklatúra derivátov benzénu sa líši v závislosti od stupňa substitúcie, aké sú substituujúce skupiny a ich relatívne pozície. Benzén tak môže trpieť opicami, di, Tri, Tetra atď., Substitúcia
Ak sú tieto dve skupiny spojené so susednými uhlíkmi, použije sa „orto“ nominálna hodnota; Ak je medzi ich oddelením uhlík, „cieľ“; A ak sú uhlíky v opačných pozíciách, „pre“.
Na nižších obrázkoch sú uvedené príklady benzénových derivátov s ich príslušnými názvami riadenými IUPAC. Sú tiež sprevádzané spoločnými alebo tradičnými menami.
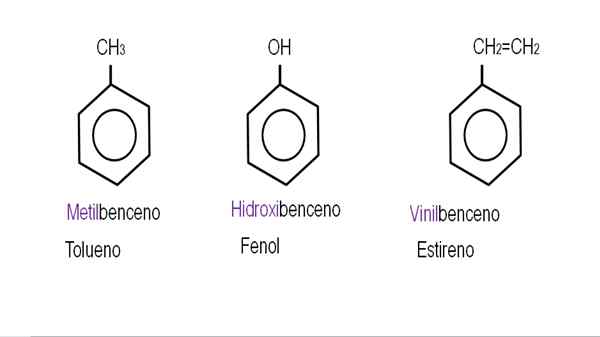 Monoderivovaný benzén. Zdroj: Gabriel Bolívar.
Monoderivovaný benzén. Zdroj: Gabriel Bolívar. 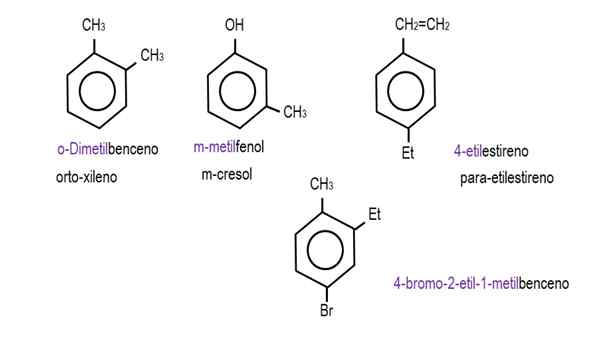 Ostatné deriváty benzénu. Zdroj: Gabriel Bolívar.
Ostatné deriváty benzénu. Zdroj: Gabriel Bolívar. Všimnite si, že v trisusteovanom benzéne ukazovatele orto, pre a cieľ, ktoré prestanú byť užitočné.
Toxicita
Benzén je zlúčenina, s ktorou sa musí starostlivo manipulovať. Vzhľadom na jeho osobitnú vôňu môžu byť okamžitými negatívnymi účinkami udusenie, závraty, bolesti hlavy, chvenie, ospalosť, nevoľnosť a dokonca smrť (pred vysokou expozíciou). Ak okrem toho, čo už bolo spomenuté, bolesti žalúdka a záchvaty môžu spôsobiť akútnu.
Okrem toho sú dlhodobé účinky pri neustálej expozícii tejto kvapaline karcinogénne; Zvyšuje šance, že jednotlivec trpí určitým druhom rakoviny, najmä krvi: leukémia.
V krvi môže znížiť koncentráciu červených krviniek, čo spôsobuje anémiu a tiež ovplyvniť kostnú dreň a pečeň, kde je asimilovaná telom, aby sa vytvorilo ešte toxickejšie deriváty benzénu; Napríklad hydroxiquinón. Hromadí sa tiež v obličkách, srdci, pľúcach a mozgu.
Odkazy
- Morrison, r.Tón. A Boyd, r. N. (1987). Organická chémia. (5. vydanie). Addison-Wesley Iberoamericana.
- Carey, f. Do. (2008). Organická chémia. (6. vydanie). McGraw-Hill, Intermerica, editor S.Do.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Národné centrum pre biotechnologické informácie. (2019). Benzén. Databáza pubchem. CID = 241, získaný z: pubchem.Ncbi.NLM.NIH.Vláda
- Wikipedia. (2019). Benzén. Zdroj: In.Wikipedia.orgán
- Garcia nissa. (2019). Čo je benzén? - Použitie, štruktúra a vzorec. Štúdium. Získané z: štúdie.com
- Centrá pre kontrolu a prevenciu chorôb. (4. apríla 2018). Fakty o benzéne. Získané z: núdze.CDC.Vláda
- Svetová zdravotnícka organizácia. (2010). Vystavenie benzénu: hlavné obavy o verejné zdravie. [PDF]. Uzdravil sa od: kto.int
- Fernández Germán. (s.F.). Problémy s nomenklatúrou benzénu. Organická chémia. Získané z: chemicicaorganica.orgán
- « Koncept kozmopolitizmu, pôvod, vízia Kant, spoločnosť
- Turistická geografická objekt štúdie, pôvod, pomocné vedy »

