Bromotimol modrá

- 2947
- 400
- Alfréd Blaho
 Bromotimol Blue je indikátor pH. Zdroj: Wikimedia Commons
Bromotimol Blue je indikátor pH. Zdroj: Wikimedia Commons Čo je bromotimol modrá?
On Bromotimol modrá Je to derivát trifenylmetana, ktorý slúži ako indikátor pH. Indikátor je organické farbivo, ktorého farba závisí od koncentrácie iónu h3Ani+ alebo stredné pH. Z dôvodu farby, ktorú vykazuje, môže indikátor označovať kyslosť alebo zásadijnosť roztoku.
Bromotimol Blue má aktívnu indikáciu medzi pH 6.0 a 7.6. Na pH média menšieho ako 6.5 (kyselina) vykazuje žlté sfarbenie. Keď sa stredné pH mení medzi 6.5 a 7.6 (neutrálne), získava zelené sfarbenie. PH viac ako 7.6 Jeho farba je modrá (základná).
Táto funkcia mu dáva skvelú užitočnosť, pretože sa dá použiť na stupnici pH blízko neutrality, presne tam, kde sa vyskytujú fyziologické procesy.
Ionizácia bromotimolu vo vodnom roztoku môže byť schematizovaná takto:
Hin (žltý) +h₂o v- (modrá farba) + h3Ani+
Ak je indikátor protonovaný (HIN), získa žlté sfarbenie; Zatiaľ čo indikátor je nechránený (v-) Sfarbenie je modré.
Chemická štruktúra
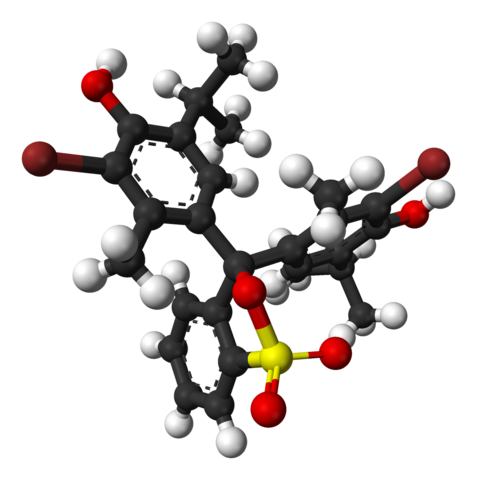 Chemická štruktúra bromotimolovej modrej. Zdroj: Wikimedia Commons
Chemická štruktúra bromotimolovej modrej. Zdroj: Wikimedia Commons Na hornom obrázku je štruktúra bromotimolovej modrej reprezentovaná s modelom typu a guľami na pH menej ako 7.1. Hnedé tyče zodpovedajú atómom brómu, celkom dva.
Každý z troch aromatických krúžkov sa skladá vedľa metylových skupín, ch3, A Thermal, skupina Timol a po spojení s BR, odtiaľ sa dôvod nazýva „bromotimol“.
Môže vám slúžiť: hydroxidyV dolnej časti je znázornená skupina sulfonátu, R-SO3-, S červenými guľami a žltou farbou. Táto skupina môže byť prepojená prostredníctvom atómu alebo centrálneho uhlíka, ktorý sa spája s tromi aromatickými krúžkami.
Zmeny pH
Táto molekulárna štruktúra, hoci sa radikálne nemení kyslým alebo základným pH, mení svoje elektronické stavy, odrážané farebnými zmenami roztokov.
Pod pH 7 je indikátor žltý a prijíma štruktúru obrazu, ale ak sa pH stane základným, skupiny -OH sú nešťastné a dvojitá väzba sa môže vytvoriť c = o.
Výsledkom je, že konjugovaný systém molekuly (zo všetkých svojich dvojitých rezonančných väzieb) sa dostatočne mení, aby elektróny už absorbovali rovnaké fotóny a roztok sa stáva zo žltej na modrú farbu.
Ak je pH na druhej strane výrazne pod 7, farba indikátora sa zmení zo žltej na červenú. Tu je zmena v konjugovanom systéme spôsobená protonáciou skupín -OH -OH2+. -
V kyslom aj základnom médiu molekula stráca stabilitu a absorbuje menšie fotóny, aby umožnila elektronické prechody zodpovedné za farby vnímané divákmi.
Zelená farba pozorovaná na hlavnom obrázku je spôsobená nasledujúcim: Keď sa pH pri 7 približuje.1, malá časť molekúl stráca protóny a rozlúči sa s modrou farbou, ktorá, miešanie so žltou farbou, dodáva zelenú farbu.
Vlastnosti DBromotimol modrá
Chemický názov
Bromotimol modrá alebo 3,3'-dibromotimolsulfonafet.
Molekulárna receptúra
C27H28Br2Ani5Siež.
Molekulová hmotnosť
624.384 g/mol.
Fyzický vzhľad
Prafový prach v siahu medzi ružovou a fialovou.
Môže vám slúžiť: bután: Štruktúra, vlastnosti, použitia a rizikáChemický charakter
Pôsobí ako slabá kyselina v roztoku. Keď je protonovaný v kyslom médiu, získa žltú farbu, neutrálne pH je zelené a keď je nepríjemné v alkalickom pH, je modrá.
Iónová disociačná konštanta (KA)
7.9 x 10-8.
Aktívny rozsah indikácií
Ph 6.0 až 7.6. Je to kvôli prítomnosti atómov brómov, ktoré pôsobia extrahovaním elektrónov, a dvoma miernymi skupinami donorov elektrónov (alkylové substituenty).
Hustota
1.25 g/cm3.
Bod topenia
202 ° C (396 ° F).
Bod varu
184.9 ° C.
Rozpustnosť
Je sotva rozpustný vo vode a oleji. Je tiež málo rozpustný v nepolárnych rozpúšťadlách, ako je benzén, toluén a xylén, a prakticky nerozpustný v olejovom éteru. Je rozpustný vo vodných roztokoch alkalis a alkoholu.
Stabilita
Je stabilný pri okolitej teplote a nekompatibilný so silnými oxidačnými činidlami.
Absorpcia svetla
Protónovaný tvar má svoju maximálnu absorpciu pri vlnovej dĺžke (A) 427 nm, takže prenáša žlté svetlo v kyslých roztokoch a nechránený tvar má maximálnu absorpciu pri vlnovej dĺžke (λ) 602 nm. zásadité pH.
Použitia a aplikácie
V metabolických štúdiách
Bromotimol Blue sa používa v mnohých procesoch, v ktorých sa vyrába oxid uhličitý (CO₂), s následnou tvorbou kyseliny uhličitej (H2Co3), ktoré okyslí médium, o čom svedčí zmena zafarbenia bromotimolovej modrej.
Ak osoba vykonáva fyzické cvičenie a je pripojená k trubici, ktorá je zase v spojení s nádobou s roztokom bromotimolovej modrej, bude pozorovaný nasledujúci fenomén: v dôsledku zvýšenia fyzickej aktivity a Metabolizmus, dôjde k zvýšeniu výroby CO₂.
Môže vám slúžiť: kremík: História, vlastnosti, štruktúra, získanie, použitieCO₂ bude reagovať s vodou a produkuje kyselinu uhličitú, h2Co3, že neskôr disociuje uvoľnenie iónu h+ a okyslenie média. To má za následok, že Bromotimol Blue získa žlté sfarbenie, ktoré zdôrazňuje kyslosť prostredia.
V pôrodníctve
Bromotimol Blue sa používa v pôrodníctve na vykazovanie skorého prasknutia membrán. Amniotická tekutina má normálne pH viac ako 7.7, tak Bromotimol Blue zafarbí modrú, keď sa dostane do kontaktu s tekutinou, ktorá uniká Amnio.
Vaginálne pH je zvyčajne kyslé, takže bromotimol modrá má žlté sfarbenie. Zmena jej farby na modrú sa prejavuje prítomnosť amniotickej tekutiny vo vaginálnej oblasti.
Iné použitia
Bromotimol Blue má tiež aplikáciu v nasledujúcich zariadeniach a funkciách:
- Optické senzory
- Systémy detekcie spaľovania plynu
- V rozpracovaní obrazov, hračiek, čistiacich výrobkov, čistiacich prostriedkov a textilu
- Senzory čerstvosti potravín
- Ako čerstvý identifikátor ryže a žltá
- Pri detekcii mikroorganizmov.
Používa sa tiež v analýze bakteriálneho rastu, psychoaktívnych liekov a zubných materiálov.
Príprava
100 mg bromotimolovej modrej sa rozpustí v 100 ml zriedeného alkoholu av prípade potreby filtre filtre. Pripravuje sa tiež nasledovne: 50 mg bromotimolovej modrej sa rozpustí v zmesi 4 ml 0,02 N hydroxidu sodného a 20 ml alkoholu, ktorý dokončí 100 ml vodou vodou.
Odkazy
- Prepožičiavať. Bromothymol Blue: Definícia, použitia a receptúra. Zotavená štúdia.com
- Indikátor Bromothymol Blue PH, 1 oz. Zotavené z ScienceCompany.com
- Spektrofotometrické stanovenie PK indikátora bromothymolovej modrej. Zotavené z FCH.Urážlivý.cz

