História síry, vlastnosti, štruktúra, získanie, použitie

- 872
- 149
- JUDr. Rudolf Čapkovič
On síra Je to nemetalický prvok, ktorý vedie pod kyslík, skupina kalkogénov v periodickej tabuľke. Je špecificky umiestnený v skupine 16 s obdobím 3 a je znázornený chemickým symbolom S. Z jeho prírodných izotopov 32S veľa spí (asi 94% všetkých atómov síry).
Je to jeden z najhojnejších prvkov na Zemi, ktorý skladá približne 3% z celkovej hmoty. To znamená, že ak by sa odobrala všetka síra planéty, bolo možné postaviť dva žlté mesiace; namiesto jedného by boli tri satelity. Môže prijať niekoľko oxidačných stavov (+2, -2, +4 a +6), takže ich soli sú početné a obohacujú pozemskú kôru a jadro.
 Kryštály síry. Zdroj: Pixabay.
Kryštály síry. Zdroj: Pixabay. Síra je synonymom žltej, zápach a peklo. Hlavným dôvodom jeho zlých zápachu je spôsobené odvodené zlúčeniny; najmä plynné a organické. Zvyšok je ich minerály pevné a majú farby, ktoré zahŕňajú žltú, sivú, čiernu a bielu (okrem iného).
Je to jeden z prvkov, ktorý najviac predstavuje široké množstvo alotropov. Sa nachádza ako malé a diskrétne molekuly S2 alebo s3; ako krúžky alebo cykly, byť ortorrombickým a monoklinickým síry8 najstabilnejší a najhojnejší zo všetkých; A ako špirálové reťazce.
Nielenže sa nachádza v pôde Cortex vo forme minerálov, ale aj v biologických matrici našich tiel. Napríklad je v aminokyselinách cystínu, cysteínu a metionín, v proteínoch železa, keratínu a vitamínov. Je tiež prítomný v cesnaku, grapefruitoch, cibule, kapuste, brokolici a kouliflor.
Chemicky je to mäkký prvok a v neprítomnosti kyslíkovej formy sulfuro minerály a sírany. Popáleniny s modrým plameňom a môže sa ukázať ako amorfná alebo kryštalická tuhá látka.
Napriek tomu, že je nevyhnutný pre syntézu kyseliny sírovej, vysoko korozívnej látky a udeľovania nepríjemných zápachov, je to vlastne benígny prvok. Síra je možné uchovávať v akomkoľvek priestore bez hlavných preventívnych opatrení, pokiaľ sa bráni požiaru.
[TOC]
História
V Biblii
Síra je jedným z najstarších prvkov v histórii ľudstva; Natoľko, že jeho objav je neistý a nie je známe, ktoré zo starodávnych civilizácií ho používali prvýkrát (4000 rokov pred Kristom). Na rovnakých stranách Biblie nájdete sprevádzanie pekelného ohňa a poruchy.
Predpokladá sa, že údajná vôňa pekla súvisí so sopečnými erupciami. Jeho prvý objavca mal určite naraziť na bane tohto prvku, pretože prachové krajiny alebo žlté kryštály v blízkosti sopky.
Starovek
Táto žltkastá pevná látka čoskoro preukázala pozoruhodné liečivé účinky. Napríklad Egypťania použili síru na liečbu zápalov viečok. Uľavilo sa tiež svrab a akné, aplikácia, ktorú dnes vidia v mydlách síry a iných dermatologických položkách.
Rimania použili tento prvok vo svojich rituáloch, ako napríklad fumigante a bielenie. Keď Librara SOS2, plyn, ktorý zaplavoval miestnosti miešajúce sa s vlhkosťou a poskytujú antibakteriálne médium a schopné zničiť hmyz.
Rimania, rovnako ako Gréci, objavili vysokú horľavosti síry, takže sa stala synonymom ohňa. Farba jeho modraiskových plameňov musela osvetľovať rímske cirkusy. Predpokladá sa, že Gréci medzitým použili tento prvok na vytvorenie zápalných zbraní.
Číňania na svojej strane sa dozvedeli, že miešanie síry so soľným bodom (Kno3) a Coal vytvoril čierny strelný prach, ktorý platil historický obrat a ktorý vzbudil v krajinách vtedajších veľkých požiadaviek a záujmu o tento minerál.
Môže vám slúžiť: Circonium: História, vlastnosti, štruktúra, riziká, použitieModerné časy
Akoby Gunpowder nebol dostatočný dôvod na túžbu na kyselinu síru, kyselinu sírovú a priemyselné aplikácie. A s prútikom kyseliny sírovej sa zmerala množstvo bohatstva alebo prosperity krajiny vo vzťahu k jej spotrebiteľskej úrovni tejto zlúčeniny.
Až v roku 1789, keď bol brilantný chemik Antoine Lavoisier schopný rozpoznať síru a klasifikovať ju ako prvok. Potom v roku 1823 nemecký chemik Eilhard Mitscherlich zistil, že síra môže prevažne kryštalizovať dvoma spôsobmi: Rhomboédrica a monoklinické.
História síry sa riadila rovnakým kanálom jej zlúčenín a aplikácií. S obrovským priemyselným významom kyseliny sírovej sprevádzal vulkanizáciu gumov, syntézu penicilínu, vykorisťovanie ťažby, rafináciu ropných surovín bohatých na síru, výživu pôdy atď.
Vlastnosti
Fyzický vzhľad
Breeze tuhá v prachu alebo kryštáloch. Jeho farba je nepriehľadná citrónová žltá, je bez chuti a chýba vôňa.
Tekutý vzhľad
Kvapalná síra je jedinečná, pretože jej počiatočná žltá farba sa stáva červenkastým a zintenzívňuje a stmaví, ak podstúpi vysoké teploty. Keď horí, povedzte modré a jasné plamene.
Molárna hmota
32 g/mol.
Bod topenia
115,21 ° C.
Bod varu
445 ° C.
zapaľovač
160 ° C.
Teplota
232 ° C.
Hustota
2,1 g/ml. Ostatné alotropy však môžu byť menej husté.
Kapacita moláru
22,75 j/mol · k
Kovalentný rádio
105 ± 3 pm.
Elektronegativita
2,58 v Pauling Scale.
Polarita
Spojenia S-S sú apolárne, pretože oba atómy síry majú rovnakú elektronegativitu. Vďaka tomu sú všetky svoje alotropy, cyklické alebo vo forme reťazcov apolar; A preto sú jej interakcie s vodou neefektívne a nemožno v ňom solubilizovať.
Síra sa však môže rozpustiť v apolárnych rozpúšťadlách, ako je disulfid uhlíka, CS2, a aromatické (benzén, toluén, xylén atď.).
Ión
Síra môže tvoriť niekoľko iónov, všeobecne aniónov. Najznámejším zo všetkých je sulfid, s2-. S2- Vyznačuje sa tým, že je objemný a mäkká základňa Lewisa.
Teória, ktorá je mäkkou základňou, uvádza, že bude mať tendenciu tvoriť zlúčeniny s mäkkými kyselinami; Rovnako ako prechodné kovové katióny vrátane viery2+, Pb2+ a cu2+.
Elektronická štruktúra a konfigurácia
Koruna síry
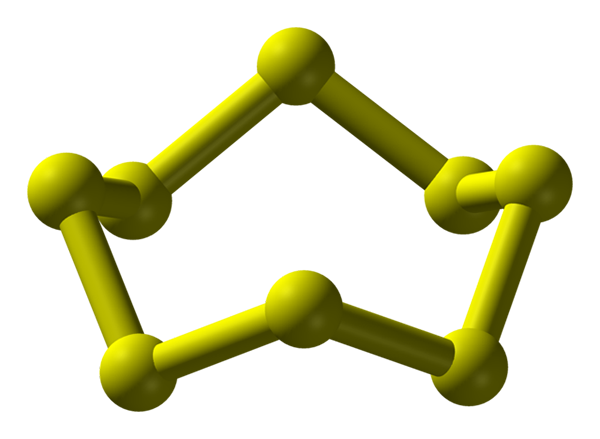 Molekula S8, najstabilnejšia a najhojnejšia alotropná síra. Zdroj: Benjah-Bmm27.
Molekula S8, najstabilnejšia a najhojnejšia alotropná síra. Zdroj: Benjah-Bmm27. Síra sa môže vyskytovať v rôznych alotropoch; A tieto majú zase kryštalické štruktúry, ktoré sú modifikované pri rôznych tlakoch a/alebo teplotách. Preto je síra bohatým prvkom v alotroposoch a polymorfoch a štúdium jej tuhých štruktúr predstavuje nekonečný zdroj teoretických experimentálnych prác.
Prečo takáto štrukturálna zložitosť? Na začiatok sú kovalentné väzby v síre (S-S) veľmi silné, prekonávané iba uhlíkom, C-C a vodíkom, H-H-H.
Síra, na rozdiel od uhlíka, nemá tendenciu tvoriť tetraedru, ale boomerangy; že s ich uhlami sa skladajú a krúžia na stabilizáciu síry. Najznámejším prsteňom zo všetkých, ktorý tiež predstavuje najstabilnejšiu alotropickú síru, je S8, „Koruna sulfur“ (vyšší obrázok).
Všimnite si, že všetky odkazy S-S8 Zdá sa, že individuálne boomerangy, čo vedie k prsteňu so záhybmi a plochými vôbec. Tieto koruny s8 Interagujú cez londýnske sily, orientované takým spôsobom, aby sa im podarilo vytvoriť štrukturálne vzorce, ktoré definujú ortombický kryštál; nazývaný s8 α (S-a alebo jednoducho ortombická síra).
Môže vám slúžiť: elastické materiályPolymorfy
Koruna síry je jedným z mnohých alotropov tohto prvku. S8 a je polymorf tejto koruny. Existujú dva ďalšie (medzi najdôležitejšími) nazývané S8 p a s8 γ (S-P a S-y). Oba polymorfy kryštalizujú v monoklinických štruktúrach, čo je S8 γ je hustejšie (sulfur gama).
Tri sú žlté tuhé látky. Ale ako sa každý polymorf získava osobitne?
S8 β pripravuje S8 a pri 93 ° C, potom umožňuje jeho pomaly ochladzovanie spomalenie jeho návratového prechodu do orrombickej fázy (a). A S8 na druhej strane sa získa, keď je založená8 a pri 150 ° C, čo umožňuje znova pomaly vychladnúť; Je to najhustejšie polymorfy sulfur.
Ďalšie cyklické alotropy
Koruna s8 Nie je to jediný cyklický. Existujú aj iné ako s4, Siež5 (Analóg k cyklopentanu), s6 (zastúpené šesťuholníkom, ako aj cyklom), s7, Siež9, a s10-20; Ten znamená, že môžu existovať krúžky alebo cykly, ktoré obsahujú od desiatich do dvadsiatich atómov síry.
Každá z nich predstavuje rôzne cyklické množstvo síry; A na druhej strane, aby to zdôraznili, majú odrody polymorfov alebo polymorfných štruktúr, ktoré závisia od tlaku a teploty.
Napríklad S7 Má až štyri známe polymorfy: a, β, y a δ. Členovia alebo koruny s vyššími molekulárnymi hmotami sú produkty organickej syntézy a v prírode nekoninujú.
Síra
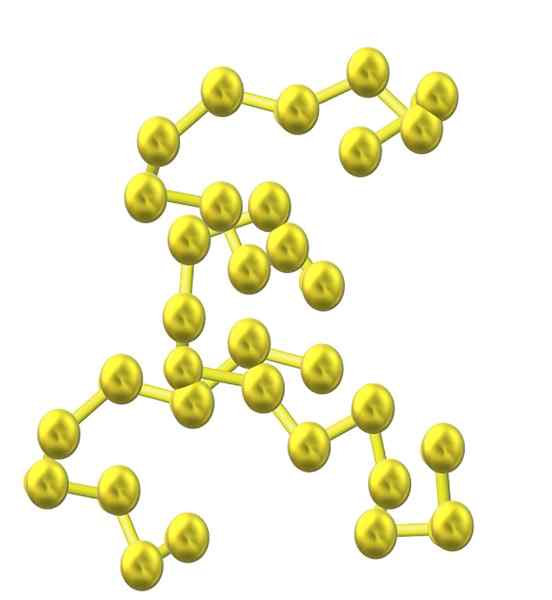 Síra. Zdroj: Opentax [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)]
Síra. Zdroj: Opentax [CC po 4.0 (https: // creativeCommons.Org/licencie/o/4.0)] Pretože do štruktúry je začlenených viac atómov síry, ich tendencia k kruhu klesá a reťazce síry zostávajú otvorené a prijímajú špirálové konformácie (akoby to boli špirály alebo skrutky).
Vyvstáva teda ďalšia objemná rodina síry, ktoré nepotýkajú krúžkov alebo cyklov, ale z reťazcov (ako je vynikajúci obraz).
Keď sa tieto reťazce S-S zarovnajú rovnobežne so sklom, zachytia nečistoty a nakoniec definujú vláknitú tuhú látku nazývanú vláknitá síra alebo s-. Ak medzi týmito paralelnými reťazcami existujú kovalentné väzby, ktoré ich prepojujú (ako s vulkanizáciou gumy), máme laminárnu sírus.
Keď síra s8 Roztopí žltkastú kvapalnú fázu, ktorá môže stmavnúť, ak sa teplota zvýši. Je to preto, že odkazy S-S sú rozbité, a preto sa vyskytuje proces tepelnej depolymerizácie.
Táto tekutina, keď chladí, vykazuje plastové vlastnosti a potom sklovité; To znamená, že sa získava sklovec a amorfná (S-Were). Jeho zloženie pozostáva z krúžkov a reťazcov síry.
A keď sa z amorfnej síry získa zmes vláknitého a laminárneho alotropu, komerčný produkt používaný na vulkanizáciu gumy.
Malé množstvo
Aj keď zostanú posledné, nie sú menej dôležité (alebo zaujímavé) ako alotropos najväčších molekulárnych hmôt. Siež2 a s3 sú sírne verzie O2 I3. V prvých dvoch atómoch síry sa spoja s dvojitou väzbou, s = s a v druhom sú tri atómy s rezonančnými štruktúrami, S = S-S.
Obidve s2 ako s3 Sú plynné. S3 Prejavte čerešňové červené sfarbenie. Obaja majú dostatok bibliografického materiálu, na ktoré sa každý pokrýva jednotlivé článok.
Elektronická konfigurácia
Elektronická konfigurácia atómu síry je:
[Ne] 3s2 3p4
Môžete si zarobiť dva elektróny na dokončenie svojho okteta vo Valencii, a preto máte oxidačný stav -2. Podobne môžete stratiť elektróny, počínajúc dvoma na svojich orbitáloch 3p, čo je oxidačný stav +2; Ak stratíte ďalšie dva elektróny, s prázdnymi orbitálmi 3p, váš oxidačný stav bude +4; A ak stratíte všetky elektróny, bude to +6.
Môže vám slúžiť: metaloidyZískanie tam, kde je síra?
Mineralogický
Síra je súčasťou mnohých minerálov. Medzi nimi je pyrit (FES2), La Galena (PBS), Covellita (CUS) a ďalšie minerály sulfátu a sulfidov. Spracovaním je možné extrahovať nielen kovy, ale aj síru po sérii redukčných reakcií.
Môže sa tiež získať čisto v sopečných prieduchoch, kde keď je teplota zvýšená a rozliate z kopca; A ak zapáli, bude vyzerať ako modrú láva. Prostredníctvom náročnej práce a namáhavých fyzických diel sa môže síra zbierať, ako sa to robilo dosť často na Sicílii.
Síra sa nachádza aj v podzemných baniach, ktoré sú vyrobené na prehriatie vody, aby sa roztopila a preniesla ju na povrch. Tento proces získania je známy ako braschový proces, ktorý sa v súčasnosti používa málo používaného.
Ropa
Dnes väčšina síry pochádza z ropného priemyslu, pretože jej organické zlúčeniny sú súčasťou zloženia ropného ropy a jej rafinovaných derivátov.
Ak je rafinovaná surová alebo produkt bohatá na síru a podlieha hydrodesulfurizácii, uvoľní veľké množstvo H2S (Stinky plyn, ktorý vonia ako zhnité vajcia):
R-S-R + 2 h2 → 2 RH + h2Siež
Potom h2S je chemicky v procese Clauss, zhrnuté s nasledujúcimi chemickými rovnicami:
3 o2 + 2 h2S → 2 SO2 + 2 h2Ani
SW2 + 2 h2S → 3 s + 2 h2Ani
Žiadosti
Niektoré z použití pre síru sú uvedené nižšie a všeobecne:
- Je to nevyhnutný prvok pre rastliny aj zvieratá. Je dokonca prítomný v dvoch aminokyselinách: cysteín a metóda.
- Je to surovina pre kyselinu sírovú, ktorá sa skladá pri príprave nespočetných komerčných výrobkov.
- Vo farmaceutickom priemysle je určený pre syntézu derivátov síry, pričom penicilín je z týchto príkladov najznámejší.
- Umožňuje vulkanizáciu gumov prepojením polymérnych reťazcov s odkazmi S-S.
- Jeho žltá farba a zmesi s inými kovmi ho robia v pigmentovom priemysle.
- Zmiešané s anorganickou matricou, ako je piesok a horniny, betón a asfalt sulfur sa pripravuje na výmenu bitúmenu.
Riziká a preventívne opatrenia
Síra sama osebe je neškodná, netoxická látka a tiež predstavuje potenciálne riziká, pokiaľ nereaguje na vytvorenie iných zlúčenín. Jeho sulfátové soli nie sú nebezpečné a môžu s nimi manipulovať bez hlavných opatrení. To sa však nestane s jeho plynnými derivátmi:2 a h2S, obaja mimoriadne toxické.
Ak je v kvapalnej fáze, môže spôsobiť vážne popáleniny. Ak sa pohltí vo veľkých množstvách, H môže spustiť H2S v čreve. Pre zvyšok nepredstavuje žiadne riziko pre tých, ktorí žuvajú.
Síra je vo všeobecnosti istá, ktorý si nevyžaduje príliš veľa preventívnych opatrení, okrem toho, že ju chránia mimo ohňa a silných oxidačných činidiel.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Laura Crapanzano. (2006). Polymorfizmus síry: štrukturálne a dynamické aspekty. Fyzika [fyzika].Univerzita Joseph -Fourier - Grenoble I. Angličtina. FFTEL-00204149F
- Wikipedia. (2019). Alotropy síry. Zdroj: In.Wikipedia.orgán
- Meyer Beat. (1976). Elementárna síra. Chemical Reviews, zv. 76, nie. 3.
- DR. Doug Stewart. (2019). Fakty o elementoch síry. Chemickolák. Získané z: Chemicool.com
- Donald W. Davis a Randall a. Detro. (2015). História síry. Georgia Gulf Sulfur Corporation. Získané z: Georgiagulfsulfur.com
- HelMestine, Anne Marie, PH.D. (11. januára 2019). 10 zaujímavých faktov síry. Zotavené z: Thoughtco.com
- Boone, C.; Puto, c.; Hallman, a.; Jenkins, J. (2017). Všeobecný prehľad o síre; Národné informačné centrum pre pesticídy, služby rozšírenia štátnej univerzity v štáte Oregon. Npic.Orst.Edu
- « Nezávislosť od Mexika, príčiny, vývoj, dôsledky, postavy
- Flóra a fauna reprezentatívnych druhov Jalisco »

