Štruktúra sodného azida (Nan3), vlastnosti, použitia, riziká

- 1350
- 327
- Václav Višňovský
Ten Azid sodný Je to kryštalická anorganická pevná látka tvorená sodným iónom Na+ A azida n ion3-. Jeho chemický vzorec je Nan3. Nan zlúčenina3 Je to sodná soľ kyseliny hydrazoovej HN3. Nan3 Je to kryštalická pevná látka bezfarebnej až bielej.
Aj keď ide o veľmi toxickú zlúčeninu, jedna z najrozšírenejších úloh bola v airbagoch, ktoré sú okamžite infikované počas nehody vozidla. Slúži tiež na rýchle nafúknutie núdzových snímok lietadla. V súčasnosti sa však jeho používanie v oboch prípadoch veľmi spochybňuje jeho toxicita.
 Nan azid sodný3 tuhý. И.С. Непоконов [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Nan azid sodný3 tuhý. И.С. Непоконов [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Používa sa v laboratóriách chemického výskumu na syntézu rôznych typov zlúčenín a v biochemických laboratóriách pre štúdie s baktériami, hubami alebo cicavcovými alebo ľudskými bunkami.
V niektorých laboratóriách sa používa na sterilizáciu materiálov alebo zariadení, ale určité typy mikroorganizmov odolávajú ich biocídnemu pôsobeniu.
Používa sa tiež v poľnohospodárstve na odstránenie parazitov pôdy alebo v drevenom priemysle, aby sa zabránilo farbeniu borovicového dreva pomocou húb.
[TOC]
Štruktúra
Sodný azida nan3 Tvorí sa sodným na katión+ a azid anión n3-.
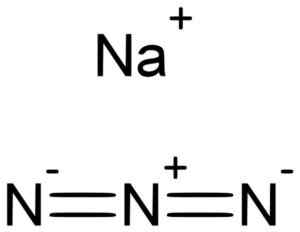 Azid sodný je tvorený sodíkom na+ A azida n ion3-. Lukáš Mižoch [verejná doména]. Zdroj: Wikimedia Commons.
Azid sodný je tvorený sodíkom na+ A azida n ion3-. Lukáš Mižoch [verejná doména]. Zdroj: Wikimedia Commons. Azida n ion3- Pozostáva z 3 atómov dusíka (n) spojených navzájom kovalentnými väzbami, ktoré môžu byť jednoduché, dvojité alebo trojnásobné, pretože medzi týmito tromi sa zdieľajú elektróny.
Tento anión má lineárnu štruktúru, to znamená, že tri atómy dusíka usporiadané v priamke. Okrem toho je štruktúra symetrická.
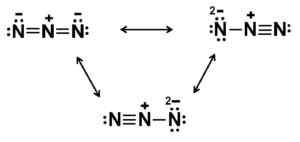 Možné Lewisove štruktúry azida aniónu. Autor: Marilú Stea.
Možné Lewisove štruktúry azida aniónu. Autor: Marilú Stea. Menovanie
- Azid sodný
- Azid sodný
Vlastnosti
Fyzický stav
Kryštalické pevné bezfarebné až biele. Hexagonálne kryštály.
Molekulová hmotnosť
65,01 g/mol
Bod topenia
Rozkladá sa pri 275 ° C.
Hustota
1 846 g/cm3 pri 20 ° C
Rozpustnosť
Je veľmi rozpustný vo vode: 41,7 g/100 ml pri 17 ° C. Je mierne rozpustný v etanole a nerozpustný v etylétele.
Disociačné konštanty
Má PKb 9.3. Vodné roztoky obsahujú NH3, ktoré rýchlo uniknú životnému prostrediu pri 37 ° C.
Chemické vlastnosti
Nan3 Je to veľmi korozívne voči hliníku a mierne smerom k meďi a oloveniu.
Môže vám slúžiť: dusíkový valenciaPodľa určitého konzultovaného zdroja nie je výbušný azid sodný výbušný. Je jemne a úplne rozkladá, keď sa zahrieva pri 300 ° C alebo viac, čím tvorí kov sodný a plynný dusík N2.
2 nan3 → 2 Na + 3 n2↑
Je to nitrografické činidlo, to znamená, že slúži na dusík alebo pridanie dusíka do iných chemických zlúčenín alebo na povrch materiálov, ako je oceľ.
Je stabilný v neutrálnej alebo zásaditej vode v neprítomnosti svetla. Rozkladá sa prostredníctvom slnečného žiarenia.
Biochemické vlastnosti
Azid sodný inhibuje enzým nazývaný cytochróm oxidáza, ktorý sa nachádza v mitochondriách buniek a je v tomto významne zapojený do dýchania a tvorby energie.
Jeho pôsobenie zabraňuje tvorbe ATP v kľúčovej zlúčenine v bunkových aktivitách a zhoršuje sa bunky alebo poškodzuje.
Ak je požitý, vdýchnutý alebo kontakt s azidom sodným, je veľmi toxický a môže sa stať smrteľným.
Získanie
NH amoniak reaguje3 S kovovým sodio Na pri 350 ° C v uzavretej oceľovej nádobe, získanie amidu z nanh sodného2.
Nanh sodný2 Reaguje s dyitrogénom oxidom n2Alebo pri 230 ° C v niklovom reaktore, a tak sa tvorí zmes nan sodného3, Hydroxid sodný NaOH a amoniak NH3.
2 nanh2 + N2O → Nan3 + Naoh + nh3
Môže sa tiež získať reakciou amidu sodíka s dusičnanom sodným3 pri 175 ° C:
3 nanh2 + Starší brat3 → Nan3 + 3 naoh + nh3
Na vyčistenie azidu sa do zmesi pridáva voda, kryštály azidu sa premyjú a potom sa voda odparuje. Kryštalický materiál, ktorý zostáva, je azid sodný nan3 to potom vyschne pri 110 ° C.
Žiadosti
V motorových vozidlách a lietadlách
Azid sodný bol široko používaný v automobilovom priemysle ako generátor dusíka na rýchle nafúknutie airbagov (angličtina Airbagy) Bezpečnosť letákov automobilov a nákladných automobilov, keď dôjde k nárazu.
Používa sa tiež v nafukovacích snímkach, ktoré slúžia na rýchle uniknutie z vnútra lietadiel, ktoré pristáli v núdzových situáciách.
V obidvoch prípadoch mechanizmus zahŕňa účinok iskry na vyvolanie okamžitej reakcie medzi azidom sodným a určitými zlúčeninami, ktorý vytvára dusíkový plyn N2 a oxid sodný na2Ani.
Môže vám slúžiť: dvojitá substitučná reakciaTáto aplikácia vyžaduje okamžité uvoľnenie studeného a netechnického plynu, takže dusík je najvhodnejší plyn.
 Bezpečnostné vrecká, ktoré už boli použité vo vozidlách. Autor: Marcel Langthim. Zdroj: Pixabay.
Bezpečnostné vrecká, ktoré už boli použité vo vozidlách. Autor: Marcel Langthim. Zdroj: Pixabay. Toto použitie však klesá v dôsledku toxicity azidu sodného a namiesto toho sa používajú menej toxické zlúčeniny.
V chemickom priemysle
Používa sa ako retardér vo výrobe gumy pre huby, aby sa zabránilo koagulácii natiahnutia alebo butadiénového latexu, keď sú uložené v kontakte s kovmi a rozkladajú dusičnany v prítomnosti dusičnanov.
V poľnohospodárstve
Používa sa v poľnohospodárstve: ako biocídny a fumigant je to tiež nematide, to znamená, že sa používa v pôdach na odstránenie nematód, ktoré sú parazity, ktoré útočia na niektoré plodiny.
 Poškodenie spôsobené nematódami v korení rastliny. Autor: Redwolf. [http: // www.Ars-mriežkový.Gov/ars/Soatlantic/fp/STPP/Burelle/Burelle.HTML] Zdroj: Wikimedia Commons.
Poškodenie spôsobené nematódami v korení rastliny. Autor: Redwolf. [http: // www.Ars-mriežkový.Gov/ars/Soatlantic/fp/STPP/Burelle/Burelle.HTML] Zdroj: Wikimedia Commons. Pracoval tiež ako herbicíd a vyhýba sa hnilobe ovocia.
Nedávno Nan3 Používa sa pri príprave semien OKRA alebo QUIMBOMBÓROV na pozorovanie jej odolnosti voči vodným zapadajúcim podmienkam.
Semená, na ktoré bol predtým nan aplikovaný3 Vytvorili sadenice, ktoré lepšie stiahli povodňové podmienky ako neprimerané, zlepšili výšku rastlín, zvýšili počet listov a zvýšili množstvo koreňov aj s nadbytkom vody.
Pri príprave iných chemických zlúčenín
Používa sa ako chemické činidlo v syntéze organických zlúčenín, napríklad na prípravu mnohých organických azidov, ako je terciárna alkylová skupina azidov, ktoré sú dôležité pri chemickej syntéze.
Slúži na prípravu kyseliny hydrazovej (HN3) a čistý sodík (NA).
Vo výbušnom priemysle
Sodný azida nan3 Je sprostredkovateľom pri výbušnej výrobe, pretože sa používa na prípravu olova azid3)2. Posledne menovaná je zlúčenina, ktorá pri silnom porazení exploduje, takže sa používa pri konštrukcii detonačných zariadení.
 Sodný azida nan3 Používa sa na výrobu olova PB (n3)2 zlúčenina, ktorá je súčasťou zariadení na generovanie výbuchov. Autor: OpenClipart-vektory. Zdroj: Pixabay.
Sodný azida nan3 Používa sa na výrobu olova PB (n3)2 zlúčenina, ktorá je súčasťou zariadení na generovanie výbuchov. Autor: OpenClipart-vektory. Zdroj: Pixabay. V biochemických laboratóriách
Azid sodný sa používa, keď sa vyžaduje sterilné laboratórne vybavenie, pretože je schopný zničiť rôzne typy mikroorganizmov.
Môže vám slúžiť: kyselina hypofyzárna (H3PO2): Vlastnosti, použitie a činidláJe to biocídne činidlo. Niektoré zdroje však naznačujú, že niektoré typy baktérií sú odolné voči ich pôsobeniu.
To sa dosiahne blokovaním väzbového miesta kyslíka v oxidázovom cytochróme, ktorý je enzýmom zapojeným do procesu výroby energie niektorých mikroorganizmov.
Používa sa v automatických krvných počítadlách, tiež pri diferenciálnom výbere baktérií a na zachovanie roztokov laboratórnych činidiel, pretože bráni rastu určitých mikroorganizmov v týchto.
Na niekoľkých použitiach
Azida sodný slúži v drevenom priemysle, aby sa zabránilo rastu hnedých húb na borovicovom dreve.
Používa sa tiež v japonskom priemysle piva, aby sa predišlo rozvoju húb, ktorá stmaví tento nápoj.
Riziká
Azid sodný je toxická zlúčenina, ktorá inhibuje dôležitý enzým na dýchanie a život ľudských a zvierat. Zistilo sa, že môže vážne ovplyvniť bunky bunkového tkaniva mozgovej krvnej cievy.
Jeho okamžitým účinkom po požití, vdýchnutí alebo kontakte s kožou je nebezpečné znižovanie krvného tlaku, čo môže viesť k smrti. Preto sa musí manipulovať s veľkou opatrnosťou.
Existujú zdroje informácií, ktoré priťahujú pozornosť na airbagy vozidiel, ktoré sú zničené na odpadových plochách.
V takýchto prípadoch môžu ľudia, ktorí nepoznajú nebezpečenstvo3, Toto je veľmi toxická zlúčenina. Okrem toho existuje nebezpečenstvo kontaminácie nanom3 pôda.
Podobne, počas nehôd, zrážky alebo vystrelenie vozidla by ľudia mohli byť vystavení Nan3 A to môže zdravotnícky personál podceňovať alebo neznámy.
Pozornosť na výstavu laboratórnych pracovníkov, ktorí ju používajú.
Odkazy
- Vwioko, e.D. a kol. (2019). Priming azidu sodného zvyšuje toleranciu stresu v okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. MDPI sa zotavila.com.
- Kho, d.Tón. a kol. (2017). Smrť endotelových buniek krvnej bariéry v krvi na azid sodný a jeho plynné produkty. Biosensors 2017, 7, 41. MDPI sa zotavila.com.
- Alebo.Siež. Lekárska knižnica. (2019). Azid sodný. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Talavera, m. a kol. (2019). Správa nematód v jahodových poliach v južnom Španielsku. Agronomy 2019, 9, 252. MDPI sa zotavila.com.
- Okano, t. a kol. (Devätnásť deväťdesiatpäť). Mechanizmus oddelenia buniek od teploty modulovaných, hydrofilní-hydrofóbnych polymérnych povrchov. V biomateriáloch: Jubilee Silver Jubilee Compendium. Zotavené z vedeckých pracovníkov.com.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A22. VCH Verlagsgellschaft MBH.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Chang, s. a Lamm, s.H. (2003). Účinky expozície azidu sodného v oblasti ľudského zdravia: prehľad a analýza literatúry. Int J Toxicol 2003, 22 (3): 175-86. NCBI sa zotavila.NLM.NIH.Vláda.

