Charakteristiky asparagíny, štruktúra, funkcie, biosyntéza
- 2497
- 335
- Tomáš Klapka
Ten Špargľa (ASN alebo N) je dôležitá aminokyselina pre bunkovú signalizáciu a spojenie medzi proteínmi a uhľohydrátmi. Toto je jedna z 22 základných aminokyselín a je katalogizovaná ako neosenciálna, pretože je syntetizovaná telom cicavcov.
Táto aminokyselina je klasifikovaná v rámci skupiny polárnych aminokyselín bez záťaže a bola prvou holou aminokyselinou, skutočnosť, ktorá sa vyskytla v roku 1806, kde bola izolovaná od špargľovej šťavy (druh bylinnej rastliny) francúzskymi chemikáliami vauquelínom a Šupka.
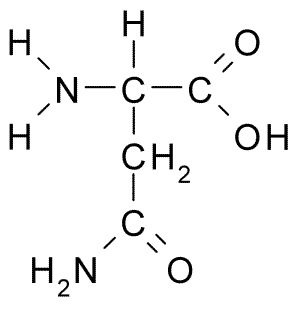
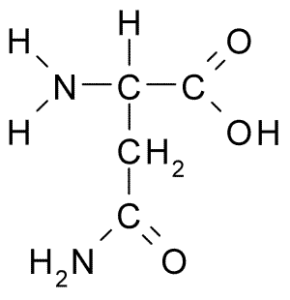 Chemická štruktúra aminokyselinového asparagínu (zdroj: borb, cez Wikimedia Commons)
Chemická štruktúra aminokyselinového asparagínu (zdroj: borb, cez Wikimedia Commons) Napriek svojmu skorému objavu nebola biologická a výživová úloha asparagínu rozpoznaná, ale o viac ako 100 rokov neskôr, keď bola v roku 1932 potvrdená jeho prítomnosť v štruktúre proteínu prítomného v semenách konope.
Asparagín a glutamín slúžia ako substráty pre amid skupiny dvoch veľmi častých aminokyselín v proteínoch: asparádna (kyselina aspartová) a glutamát (kyselina glutámová). Asparagín a glutamín sa v týchto aminokyselinách ľahko hydrolyzujú enzymatickým účinkom alebo kyslými a základnými zlúčeninami.
Mnoho proteázových serínových enzýmov, ktoré sú zodpovedné za hydrolyzovacie peptidové väzby, majú asparagín v bočnom reťazci svojho aktívneho miesta. Tento zvyšok má negatívne čiastočné zaťaženie a je zodpovedný za spojenie s kladným zaťažením bielych peptidov, priblíženie sa k miestu na rezanie.
Enzým zodpovedný za syntézu oxalacetátu z asparagínu sa používa pri chemoterapeutických ošetreniach a je známy ako L-asparagináza, ktorá je zodpovedná za katalyzáciu hydrolytickej fragmentácie amida asparagínu na aspartát a amonium.
Asparagináza je nadmerne exprimovaná a čistená z Escherichia coli, Injekcia u pacientov detí, ktorí majú akútnu lymfoblastickú leukémiu, pretože normálne aj malígne lymfocyty závisia od zachytenia asparagínu v krvi na rast a násobenie.
[TOC]
Vlastnosti
Všetky chemické štruktúry aminokyselín majú karboxylovú skupinu (-COH), aminoskupinu (-NH3+), vodík (-H) a R alebo substituentnú skupinu, ktorá je spojená s rovnakým atómom centrálneho uhlíka, známy ako uhlík α.
Aminokyseliny sa navzájom líšia identitou svojich bočných reťazcov, ktoré sú známe ako skupiny R a ktoré sa môžu meniť vo veľkosti, štruktúre, funkčných skupinách a dokonca aj elektrickým nábojom.
Atómy uhlíka R skupiny sa stotožňujú s písmenami z gréckej abecedy. V prípade asparagínu sú teda uhlíky reťazca R identifikované ako karbóny β a y.
Môže vám slúžiť: Agar XLD: Nadácia, príprava a použitiaPodľa iného typu nomenklatúry je atóm uhlíka v karboxylovej skupine (-COH) uvedený ako C-1, takže pokračuje s číslovaním, uhlík α by bol C-2 atď.
Molekula asparagínu má štyri atómy uhlíka, vrátane uhlíka a karboxylovej skupiny a dva atómy uhlíka, ktoré sú súčasťou skupiny R, známe ako karboxamid (-ch2-Co-Co-NH2).
Táto skupina karboxamidov sa nachádza iba v dvoch aminokyselinách: v asparagíne a glutamíne. Má charakteristiku, že môže s aminoskupinou (-NH2) a karbonylovou skupinou tvoriť vodíkové mosty (-NH2) a karbonylovej skupiny (-Co).
Klasifikácia
Asparagín patrí do skupiny polárnych aminokyselín bez záťaže, ktoré sú veľmi rozpustné aminokyseliny vo vode a veľmi hydrofilné (kvôli ich tvorbe viacerých vodíkových mostov).
V skupine polárnych aminokyselín bez záťaže sú tiež serín, treonín, cysteín a glutamín. To všetko sú zlúčeniny “Zwitteriónia“, Pretože vo svojom reťazci R majú polárnu skupinu, ktorá prispieva k neutralizácii zaťaženia.
Všetky polárne aminokyseliny bez záťaže nie sú ionizovateľné pri pH blízko 7 (neutrálne), to znamená, že nemajú pozitívne alebo negatívne náboje. Avšak v kyslom a základnom médiu sú substituenty ionizované a získavajú bremeno.
Stereochémia
Centrálny uhlík alebo uhlík z aminokyselín je chirálny uhlík, potom má štyri rôzne United Substituents, ktoré spôsobujú najmenej dva rozlíšiteľné stereoizoméry pre každú aminokyselinu.
Stereoizoméry sú zrkadlové obrazy molekuly, ktoré majú rovnaký molekulárny vzorec, ale nie sú navzájom superponovateľné, ako sú ruky (vľavo a vpravo). Sú označené písmenom D alebo L, pretože experimentálne roztoky týchto aminokyselín otáčajú polarizovanú svetelnú rovinu v opačných smeroch.
Všeobecná asymetria aminokyselín robí stereochémiu týchto zlúčenín veľmi dôležitý, pretože každá z nich má rôzne vlastnosti, je syntetizovaná a podieľa sa na rôznych metabolických trasách.
Asparagín sa nachádza vo forme D-Asparagínu alebo L-asparagínu, pričom druhý je najčastejší charakter. Je syntetizovaný pomocou L-syntezázy a metabolizovaný pre L-asparaginázu, oba enzýmy sú veľmi hojné v pečeni stavovcov.
Funkcia
Jednoduché formovanie asparagínových vodíkových mostov z neho robí rozhodujúcu aminokyselinu pre štrukturálnu stabilitu proteínov, pretože môže tvoriť vnútorné vodíkové mostíky s bočnými reťazcami ostatných aminokyselín, ktoré ich tvoria.
Môže vám slúžiť: 25 príkladov asexuálnej reprodukcieAsparagín sa zvyčajne nachádza na povrchu typického vodného média, čo stabilizuje ich štruktúru.
Mnoho glykoproteínov sa môže viazať na uhľohydráty alebo uhľohydráty prostredníctvom zvyšku asparagíny, treonínu alebo serínu. V prípade asparagínu je acetyllaktozamín všeobecne spojený s aminoskupinou N-glycykozyláciou.
Je dôležité zdôrazniť, že vo všetkých n-glykozylovaných glykoproteínových uhľohydrátoch sa na ne viažu prostredníctvom asparagínového zvyšku, ktorý je v špecifickej oblasti označenej ako ASN-X-SER/THR, kde x je akákoľvek aminokyselina.
Tieto glykoproteíny sú zostavené v endoplazmatickom retikule, kde sú glykozylované, keď sú preložené.
Biosyntéza
Všetky eukaryotické organizmy sa prispôsobia amoniaku a transformujú ho na glutamát, glutamín, karbamil-fosfát a asparagín. Asparagín sa môže syntetizovať z glykolytických sprostredkovateľov, v cykle kyseliny citrónovej (z oxalacetátu) alebo z prekurzorov konzumovaných v diéte.
Asparagínový enzým syntetázy je amidotransferáza v závislosti od glutamínu a ATP, že ATP a anorganické pyrofosfát (PPI) pľutia a používa amoniak alebo glutamín na katalyzáciu amidačnej reakcie a premieňa asparagín na asparagín.
Baktérie aj zvieratá majú asparagín syntetázy, v baktériách však enzým používa amónny ión ako donor dusíka, zatiaľ čo u cicavcov synteticka syntetáza používa glutamín ako hlavný darca skupiny dusíka.
Enzymatické prasknutie ATP na AMP a anorganický pyrofosfát (PPI), spolu s glutamínom ako darcom skupiny Amida, sú hlavnými rozdielmi v súvislosti s biosyntézou L-glutamínu medzi rôznymi organizmami.
Degradácia
Väčšina štúdií o metabolizme asparagínu sa uskutočňovala v rastlinách, vzhľadom na skutočnosť, že spočiatku štúdie na cicavci boli bránené nedostatkom metodík dostatočne citlivých na testy aminokyselín na úrovni komplexnejších systémov.
L-asparagín sa neustále hydrolyzuje u cicavcov L-asparaginázou, aby spôsobil kyselinu asparátovú a amónny. Používa sa na syntézu glykoproteínov a je jedným z hlavných prekurzorov oxalacetátu pre cyklus kyseliny citrónovej.
Enzým asparaginázy katalyzuje hydrolýzu asparagínu na aspartát, následne sa aspartát transamminuje a-ceglutarátom za vzniku glutamátu a oxalacetátu.
Môže vám slúžiť: epiblastSynteta asparagín, známa tiež ako aspartát-amoniako ligáza, sa nachádza hojne z cicavčích mozgových buniek.
Keď sa v tele vnímajú nízke hladiny tohto enzýmu, vytvára sa to, čo sa nazýva „aminokidopatia“, pretože v cytoplazme mozgových buniek sa hromadia prekurzorové substráty v cytoplazme mozgových buniek.
Potraviny bohaté na špargľu
Ľudia, ktorí majú akútnu lymfoblastickú leukémiu, majú zvyčajne nedostatky vzhľadom na enzýme asparagínu syntetáz a závisia od asparagínu v obehu, takže sa odporúča diéta v potravinách bohatých na asparagín alebo exogénne dodávky rovnakého.
Medzi viac potravín s vysokým obsahom asparagíny patrí ona.
Existujú koncentráty L-asparagínu, ktoré sú formulované pre športovcov s vysokou konkurenciou, pretože ich spotreba pomáha regenerovať proteíny, ktoré tvoria tkanivá.
Okrem toho ľudia, ktorí majú deficit v aminokyselinovej syntéze.
Asparagín sa ľahšie metabolizuje prostredníctvom svojej formy L-asparagínu, pretože mnoho enzýmov zapojených do ich metabolizmu neuznáva formu D-asparagínu, a preto nie všetky špargíne požitené v potravinách sú k dispozícii pre rôzne organizmy.
Hojný príjem asparagíny môže byť prospešný, ale odporúča sa však.
Odkazy
- Cooney, D. Do., Capizzi, r. L., & Handschumacher, R. A. (1970). Hodnotenie metabolizmu L-asparagínu v Anims a Man. Výskum rakoviny, 30 (4), 929-935
- Dunlop, P. C., Roon, R. J., & Dokonca, h. L. (1976). Použitie D-asparagínu Saccharomyces cerevisiae. Journal of Bakteriológia, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, f. (2017). Pokroky v metabolizme asparagíny. V Pokrok v botanike Zvuk. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Zostavenie oligosacharidov spojených s špargou. Ročné preskúmanie biochémie, 54 (1), 631-664
- Mathews, C. Klimatizovať., & Ahern, K. G. (2002). Biochémia. Pearson Vzdelanie.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Yamada, K., Hashizume, D., Shimizu, T., & Yokoyama, s. (2007). L-asparagín. Kryštalografický čin Oddiel E: Správy o štruktúre online, 63 (9), 3802-3803.
- « Charakteristiky kyseliny glutámovej, funkcie, biosyntéza
- Charakteristiky rúk, štruktúra, funkcie »

