História arzénu, štruktúra, vlastnosti, použitie

- 4165
- 374
- Tomáš Klapka
On arzén Je to semimetálny alebo metaloid, ktorý patrí do skupiny 15 alebo prechádza z periodickej tabuľky. Je reprezentovaný chemickým symbolom ako a má atómové číslo 33. Môže to byť pod tromi alotropnými formami: žltá, čierna a šedá; Ten je jediný s priemyselným významom.
Gray Arsenic je kovový, krehký tuhý, s kovou a kryštalickou farbou (spodný obrázok). Stráca svoj jas, keď je vystavený vzduchu tvoriaceho oxid arzenioso (ako2Ani3), ktoré pri vyhrievaní vydáva zápach cesnaku. Na druhej strane sú jeho žlté a čierne alotrochos molekulárne a amorfné, respektíve.
 Kovový arzén. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Kovový arzén. Zdroj: Hi-RES obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Arsenic sa nachádza v zemskej kôre spojenej s mnohými minerálmi. Iba malá časť je v pôvodnom stave, avšak spojená s antimónom a striebrom.
Medzi najbežnejšie minerály, v ktorých patrí arzén4Siež4), oropiment (ako2Siež3), Loellingita (škaredé2) a enargita (cu3Zadok4). Arsenic sa získava aj ako kolaterálny produkt zlievárne kovov, ako sú olovo, meď, kobalt a zlato.
Zlúčeniny arzénu sú toxické, najmä Arsina (popol3). Arsenic má však početné priemyselné aplikácie vrátane zliatiny s olovom, používané pri vypracovaní autobusov a zliatiny s galliom s niekoľkými použitiami v elektronike.
[TOC]
História vášho objavu
Názov „arzénu“ pochádza z latinského arzénu a gréckeho arzenikonu, ktorý sa týka žltého oropimentu, ktorý predstavoval hlavnú formu použitia arzénu alchymistom.
Arzén dlho predtým, ako bol rozpoznávaný ako chemický prvok, bol známy a použitý vo forme jeho zlúčenín. Napríklad Aristoteles v štvrtom storočí.C. Napísal o sandárach, látke, ktorá sa teraz predpokladá, že to bol sulfid arzénu.
Plinio El Viejo a Pivanio Discorides, v 1. storočí.C., Opísali oropiment, minerál predstavovaný2Siež3. V jedenástom storočí boli rozpoznané tri druhy arzénu: biele (ako4Ani4), Žltá (ako2Siež3) a červené (ako4Siež4).
Arsenic ako čistý prvok bol prvýkrát pozorovaný Albertus Magnus (1250). Magnus zahrievaný sulfid arzénu s mydlom, ktorý si všimol vzhľad látky s charakteristikou podobnou sivej šedej obrazu obrázka. Prvú autentickú správu o jej izolácii však uverejnila v roku 1649 nemecký farmaceut Johann Schroeder.
Schroeder pripravil arzén zahrievaním oxidu uhlia. Následne sa Nicolas Lémery podarilo zahriať zahrievaním zmesi oxidu arzénu, mydla a potaše. V 18. storočí bol tento prvok konečne uznaný ako semimetal.
Môže vám slúžiť: žiadne elektrolyty: charakteristiky a príkladyArzén
Arzén je izomorfný na antimón; To je, štrukturálne sú identické a líšia sa iba veľkosťou svojich atómov. Každý atóm arzénu tvorí tri as-as kovalentné putá, takým spôsobom, že vznikajú aj šesťuholníkové jednotky6 „Zletené alebo strmé“, pretože hybridizácia ATOMS je SP3.
Potom jednotky6 Spájajú sa, čo vedie k strmým arzénovým vrstvám, ktoré navzájom slabo interagujú. Podľa svojich medzimolekulárnych síl, hlavne závislí od ich atómových hmôt, sivé kryštály rhomnénskeho arzénu dodávajú pevnú krehkú a krehkú textúru.
Pravdepodobne kvôli odporom arzénových elektrónov, jednotiek6 Vytvorené medzi paralelnými vrstvami nedefinujú dokonalý oktaedron, ale skreslené:
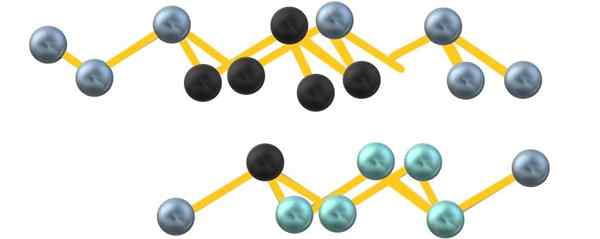 Šedá kryštalická štruktúra arzénu. Zdroj: Gabriel Bolívar.
Šedá kryštalická štruktúra arzénu. Zdroj: Gabriel Bolívar. Všimnite si, že čierne gule nakreslia zdeformovanú rovinu v priestore medzi dvoma strmými vrstvami. Tiež vo vrstve pod nimi sú moderné gule, ktoré vedľa čiernej gule tvoria jednotku6 uvedené na začiatku sekcie.
Štruktúra vyzerá objednané, riadky stúpajú a klesajú, a preto je kryštalická. Môžete sa však stať amorfným, so stlačenými sférami rôznych spôsobov. Keď sa stane amorfný sivastý arzén, stáva sa polovodičom.
Žltý arzén
Žltý arzén, najtoxickejší alotropický z tohto prvku, je iba molekulárna tuhá látka. Pozostáva z molekúl4 jednotky slabých disperzných síl, ktoré im nebránia v plnení.
Čierny arzén
Čierny arzén je amorfný; Ale nie ako môže byť šeddijastý. Jeho štruktúra je mierne podobná nedávnemu6 Majú väčšie oblasti a rôzne vzorce poruchy.
Elektronická konfigurácia
[AR] 3D104s24p3
Má všetky orbitály úrovne 3 plné. Odkazy na formuláre s použitím orbitálov 4S a 4p (ako aj 4d) rôznymi chemickými hybridizáciami.
Vlastnosti
Molekulová hmotnosť
74,922 g/mol
Fyzický popis
Gray Arsenic je sivou kovovou pevnou látkou a krehkou konzistenciou.
Farba
Tri alotropné formy, žltá (alfa), čierna (beta) a šedá (gama).
Vôňa
Záchod
Príchuť
Bez chuti
Bod topenia
1.090 K pri 35,8 atm (Triple Arsenic Point).
Pri normálnom tlaku nemá žiadny bod fúzie, pretože sublimuje 887 K.
Hustota
-Šedá arzén: 5,73 g/cm3.
Môže vám slúžiť: Carbonyl Group: Charakteristiky, vlastnosti, nomenklatúra, reaktivita-Žltý arzén: 1,97 g/cm3.
Rozpustnosť
Nerozpustný
Atómové rádio
139 hod
Atómový objem
13,1 cm3/mol
Kovalentný rádio
120 hod
Špecifické teplo
0,328 j/g · mol pri 20 ° C
Odparovacie teplo
32,4 kJ/mol
Elektronegativita
2,18 v Paulingovej stupnici
Ionizačná energia
Prvá ionizačná energia 946,2 kJ/mol
Oxidačné stavy
-3, +3, +5
Stabilita
Elementárny arzén je stabilný v suchom vzduchu, ale keď je vystavený vlhkému vzduchu, je pokrytý žltou bronzovou vrstvou, ktorá sa môže stať čiernou vrstvou oxidu arzénu (2Ani3).
Rozklad
Keď sa arzén zahrieva na rozklad, vydáva biely dym2Ani3. Tento postup je nebezpečný, pretože Arsina je tiež možné emitovať, veľmi jedovatý plyn.
Sebaprečovanie
180 ° C
Tvrdosť
3.5 na stupnici tvrdosti Mohs.
Reaktivita
Nesmie na to napadnutá kyselinou sírovou alebo koncentrovanou kyselinou chlorovodíkovou. Reaguje s kyselinou dusičnou alebo kyselinou sírovou, tvoriaci kyselinu arzenóznu a kyselinu arzenovú.
Keď sa šedá arzén prchaví zahrievaním a výpary sa rýchlo ochladia, vytvorí sa žltý arzén. Toto sa vracia do šedivého tvaru, keď je vystavený ultrafialovému svetlu.
Žiadosti
Zliatiny
Malé množstvo arzénu pridaných na olovenie, stvrdne jeho zliatiny dostatočne na to, aby ich použil pri výstelke káblov a pri vypracovaní autobusov.
Pridanie arzénu do mosadze, zliatiny medi a zinku, zvyšuje jeho odolnosť voči korózii. Na druhej strane opravuje alebo znižuje stratu zinku v mosadze, čo spôsobuje zvýšenie jeho životnosti.
elektronika
Purifikovaný arzén sa používa v polovodičovej technológii, kde sa používa v spojení s Gallic.
GaA majú interval priameho pásma, ktorý sa môže použiť pri výrobe diód, laseru a LED. Okrem Gallium Arseniuro existujú aj ďalšie arzeniurské, ako napríklad indický arzeniuro a hliník Arseniuro, ktoré tiež tvoria II-V polovodiče II-V.
Medzitým je Cadmium Arseniuro polovodičom typu II-IV. Arsina sa používa v polovodičovom dopingu.
Poľnohospodárstvo a ochrana dreva
Väčšina aplikácií bola vyradená z dôvodu ich veľkej toxicity a ich zlúčenín. Ako2Ani3 sa používa ako pesticíd, zatiaľ čo eso2Ani5 Je to zložka herbicídov a insekticídov.
Kyselina arzén (H3ASO4) a soli, ako je arzenán vápnika a olovo, sa použili na sterilizáciu pôdy a kontrolné škodcov. To predstavuje riziko znečistenia životného prostredia arzénom.
Môže vám slúžiť: tekuté prvky: Čo sú a príkladyOlovo Arseniato sa použil ako insekticíd v ovocných stromoch, až do prvej polovice dvadsiateho storočia. Ale vďaka svojej toxicite bol nahradený metylarsenátom sodným, ktorý sa od roku 2013 prestal používať z rovnakého dôvodu od roku 2013.
Liečivý
Až do dvadsiateho storočia sa ako lieky použilo niekoľko zlúčenín. Napríklad Arsfenamina a Neolsalvarsan sa použili pri liečbe syfilis a triposomiázy.
V roku 2000 bolo použitie AS schválené2Ani3, Veľmi toxická zlúčenina pri liečbe akútnym promineo-rezistentným sľubom na kyselinu kyselinu retino-trans-trans. Nedávno bol použitý rádioaktívny izotop 74Pokiaľ ide o umiestnenie nádorov.
Izotop vytvára dobré obrázky, jasnejšie ako tie, ktoré sa získavajú s 124I, pretože jód je odvedený na štítnu žľazu a vytvára v signáli hluk.
Iné použitia
Arzén sa v minulosti použil ako prísadný krmivo pri výrobe hydiny a ošípaných.
Používa sa ako katalyzátor vo výrobe etylénexidu. Používa sa tiež v pyrotechnike a opáleni. Oxid arzenioso sa používa ako odfarbenie vo výrobe skla.
Kde sa to nachádza?
Arzén sa nachádza v malých množstvách v základnom stave, s vysokým stupňom čistoty. Je prítomný v mnohých zlúčeninách, ako sú: sulfidy, arzenuros a sulfarseniurózy.
Nachádza sa tiež v niekoľkých mineráloch, vrátane: arzenopyritu (FESA), Loellingita (škaredé2), enargita (cu3Zadok4), oropiment (ako2Siež3) A Rejalgar (ako4Siež4).
Ako sa získa?
Arsenopirita sa zahrieva na 650-700 ° C, v neprítomnosti vzduchu. Arzén sa odparuje a zostáva sulfid železa (FES) ako zvyšok. Počas tohto procesu sa arzén viaže na kyslík na vytvorenie4Ani6, Známy ako „biely arzén“.
Ako4Ani6 Je upravený tak, aby tvoril AS2Ani3, ktorých výpary sa zhromažďujú a kondenzujú v množine tehlových kamier, čím čistí arzén sublimáciou.
Väčšina arzénu sa produkuje znížením uhlíka z prachu tvoreného z2Ani3.
Odkazy
- Stephen R. Marsden. (23. apríla 2019). Chémia arzénu. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- HelMestine, Anne Marie, PH.D. (3. decembra 2018). Zaujímavé fakty o arzéne. Zotavené z: Thoughtco.com
- Wikipedia. (2019). Arzén. Zdroj: In.Wikipedia.orgán
- DR. Cesto. (2019). Fakty o arzénových prvkoch. Chemickolák. Získané z: Chemicool.com
- Kráľovská spoločnosť chémie. (2019). Arzén. Získané z: RSC.Alebo
- Redaktori Enyclopaedia Britannica. (3. mája 2019). Arzén. Encyclopædia Britannica. Získané z: Britannica.com
- « Charakteristické menšinové skupiny, typy, príklady
- Reynoldsovo číslo, pre čo ide, ako sa vypočíta, cvičenia »

