Podporné funkcie, funkcie a príklady
- 1271
- 168
- Adrián Fajnor
Ten podpora Sú to neaktívne formy enzýmov, to znamená, že sú to enzýmy, ktoré chýbajú ich kofaktory alebo koenzýmy, ktoré sú nevyhnutné na vykonávanie katalytických reakcií, z ktorých majú na starosti.
Enzýmy sú proteíny s katalytickou aktivitou. Jeho funkcia v podstate urýchľuje priebeh rôznych typov chemických reakcií v bunkách, čo je veľmi dôležité pre existenciu všetkých živých bytostí na Zemi.
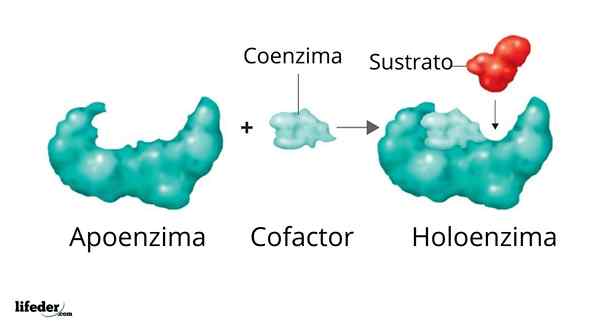
 Holoenzým je tvorený podporovateľom a jeho kofaktorom/koenzýmom/protetickou skupinou
Holoenzým je tvorený podporovateľom a jeho kofaktorom/koenzýmom/protetickou skupinou Aktivita mnohých enzýmov závisí od identity a usporiadania aminokyselín, ktoré ich tvoria, to znamená na ich vlastných proteínových štruktúrach a od integrity týchto štruktúr v podmienkach domorodý.
Aj keď to platí pre mnoho enzýmov, existujú niektoré, ktoré si na vykonávanie svojich funkcií vyžadujú ďalšie ne -proteínové prvky. Takéto prvky sú známe ako Kofaktory, Ak ide o anorganické ióny, alebo koenzýmy, Ak sú to zložité alebo organické molekuly.
Všeobecne platí, že kofaktory aj koenzýmy sú spojené s relatívnou stabilitou s proteínovou štruktúrou enzýmov, ktorých katalytická aktivita podporuje; Ak je táto asociácia trvalá (kovalentná), tieto skupiny sú potom známe ako Protetické skupiny.
Príklady podpory
 3D ilustrácia DNA polymerázy
3D ilustrácia DNA polymerázy Aktívna enzymatická sada tvorená proteínom s katalytickou aktivitou a jeho kofaktor/koenzým/protetická skupina sa nazýva Holoenzým ani konjugovaný enzým. V holoenzýme proteínová časť zodpovedá tomu, čo je známe ako podporný alebo apoproteín, ktorý nemá aktivitu.
Príklady niektorých dôležitých podpory sú:
- Enzým DNA polymeráza, Zodpovedá za replikáciu bunkovej DNA, bez dvojmocného iónu horečnatého, ktorý slúži ako kofaktor.
- Enzým Karbonová anhydráza, zodpovedný za katalyzovanie konverzie CO₂ a H₂0 na hydrogenuhličitan a H+ióny, bez dvojitého zinočnatého iónu, ktorý slúži ako kofaktor.
- Enzým hemoglobín, zodpovedný za transport kyslíka vo vnútri červených krviniek (erytrocyty) krvou cicavcových zvierat, bez ich protetickej skupiny HEMO.
- Enzým laktát dehydrogenáza, zodpovedný za výrobu laktátu z pyruvátu, bez NADH, ktorý slúži ako kofaktor.
Charakteristiky apoenzýmov
Podpora sú neaktívne enzýmy, ktoré potrebujú, aby dosiahli svoju aktiváciu, spojenie kofaktora alebo koenzýmu, ale ktoré nie sú spojené s jedným.
Berúc do úvahy to, dá sa povedať, že takéto molekuly zdieľajú určité charakteristiky, a to:
Sú to proteíny
Na rozdiel od kofaktorov a koenzýmov, ktoré sú ne -proteínovými prvkami potrebnými pre funkcie holoenzýmov, podpora sú proteíny.
Predchádzajúce vyhlásenie sa teda chápe, že podpory sú tvorené reťazcami špeciálnych molekúl známych ako aminokyseliny, ktoré sú spojené prostredníctvom typu spojenia známeho ako peptidová väzba.
Aminokyselinová sekvencia každej podpory je geneticky určená, čo zase podmienky jej priestorového alebo trojrozmerného poriadku, úzko súvisiace so špecifickosťou substrátov, spojením s kofaktormi/koenzýmami/protetickými skupinami, zavedením aktívneho miesta, atď.
Ako proteíny majú tiež apoenzýmy: elektrický náboj, určený obsahom ich aminokyselín a pH média, kde sa nachádzajú; Požiadavky na teplotu, pH a iónovú silu charakteristické, v ktorých môže v prítomnosti kofaktorov fungovať pri optimálnej rýchlosti; inhibítory a konkurenti, atď.
Môžu sa pripojiť k substrátom
Aj keď sami nie sú schopní katalyzovať enzymatickú reakciu, veľa podpory si zachováva schopnosť pripojiť sa k substrátom, ktoré sa zúčastňujú na reakcii, ktorá ich charakterizuje; Z tohto dôvodu sa zvyčajne používajú v niektorých experimentálnych kontextoch.
Môžu sa pripojiť k kofaktorom, koenzýmom alebo protetickým skupinám
Vo väčšine prípadov možno podpory považovať za neaktívne enzýmy, ktoré sú pripravený Pripojiť sa k týmto molekulám, ktoré sa zúčastňujú ich funkcií, to znamená: do ich kofaktorov, koenzýmov alebo protetických skupín.
Môže vám slúžiť: Flora a fauna ekvádorského pobrežiaKofaktory sa môžu zúčastňovať priamo na katalytických reakciách alebo jednoducho prispievať k stabilizácii všeobecnej štruktúry holoenzýmov.
Medzi hlavné kofaktory, ktoré sa zúčastňujú na bunkových holoenzýmoch, patria:
- Železo (Fe2+)
- Meď (Cu2+)
- Vápnik (Ca2+)
- Zinok (Zn2+)
- Horčík (MG2)
- Mangán (MN2+)
- Kobalt (CO)
- Nikel (ni)
Medzi hlavnými koenzýmami je možné vymenovať:
- Vitamíny: B9, B3, C
- Adenosín Triffosfát (ATP)
- Flavín Adenín Dincleotid (výstrelok)
- Nikotinamid alebo nikotín dinukleotid dycleotid (NAD)
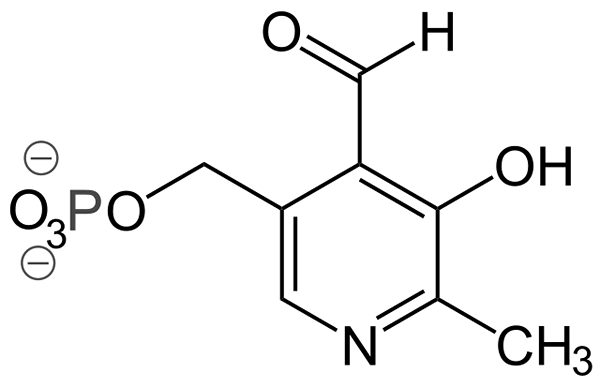 Štruktúra piridoxálneho fosfátu (zdroj: Ayacop, verejná doména, cez Wikimedia Commons)
Štruktúra piridoxálneho fosfátu (zdroj: Ayacop, verejná doména, cez Wikimedia Commons) Niektoré dôležité protetické skupiny sú:
- Skupina
- Biotín
- Tiamín pyrofosfát
- Pyridoxálny fosfát
Funkcie subenzimov
Pretože podpory sú proteínové časti holoenzýmov, je spravodlivé ich považovať za svoju najdôležitejšiu časť. Dokonca aj v prítomnosti vhodných koenzýmov, koenzýmov a substrátov, bez podpory, sa nedalo vykonať žiadna z enzymatických reakcií katalyzovaných týmito enzýmami.
V tomto zmysle je hlavnou funkciou podpory prispievať hlavnou štruktúrou holoenzýmu, do ktorého patrí, ako miesto únie pre kofaktor, koenzým a/alebo protetickú skupinu a substráty, ktoré sa zúčastňujú na reakcii.
Zo štrukturálneho hľadiska nie je holoenzým bez jeho apoenzýmu ničím iným ako kofaktorom a samotný kofaktor nie je ničím iným ako relatívne inertnou molekulou (biologicky), takže podpora je v skutočnosti zodpovedná katalytická reakcia, ktorú pomáhajú uvedené prvky neproteínu.
Môže vám slúžiť: aktinomycetesFunkcie podpory, hoci sú to neaktívne enzýmy, závisia od:
- Jeho lineárny reťazec aminokyselín alebo primárnej štruktúry (ak ide o enzymatické komplexy tvorené viac ako jednou podjednotkou, potom by sa diskutovalo o „ich lineárnych reťazcoch“).
- Spôsob, akým sú tieto reťazce usporiadané vo vesmíre, tj sekundárne, terciárne a kvartérne štruktúry, keď je to tak.
- Správna konformácia miest, ktoré sú základné pre katalýzu, tj katalytické miesto s aminokyselinami, ktoré sa zúčastňujú na reakcii, miesto únie pre Co -enzýmy, koenzýmy alebo protetické skupiny; atď.
- Stabilita štruktúry v bunkových podmienkach alebo domorodý, Skutočnosť, ktorá priamo súvisí so schopnosťou apoenzýmu tvoriť holoenzým a ďalšie.
Odkazy
- Boyer, P. D., & Krebs a. G. (1986). Enzýmy. Akademická tlač.
- Garrett, R. H., & Grisham, C. M. (2001). Zásady biochémie: s ľudským zameraním. Vydavateľstvo Brooks/Cole.
- Gruber, K., Puffer, b., & Kräutler, B. (2011). Vitamín B 12-deriváty-enzým-faktory a ligandy proteínov a nukleových kyselín. Chemical Society Reviews, 40 (8), 4346-4363.
- Murray, r. Klimatizovať., Granner, D. Klimatizovať., Mayes, P. Do., & Rodwell, V. W. (2014). Harperova ilustrovaná biochémia. McGraw-Hill.
- Nelson, D. L., Lehninger, a. L., & Cox, M. M. (2008). Lehninger princípy biochémie. Macmillan.
- Staiano, m., Pennacchio, a., Varriale, a., Capo, a., Majoli, a., Capacchione, C., & D'Auria, s. (2017). Enzýmy ako senzory. V metódach v enzymológii (zv. 589, pp. 115-131). Akademická tlač.
- « Predkladateľ petície pre to, čo je použitie, napríklad formát (model)
- Vetvené dýchanie, ako sa to robí, a príklady »

