História antimónov, štruktúra, vlastnosti, použitia a riziká

- 4983
- 1328
- JUDr. Rudolf Čapkovič
On antimón Je to lesklý, strieborný metalloid a s určitým modrým odtieňom. Jeho pevná látka sa tiež vyznačuje tým, že je veľmi krehká a skvamózna textúra. Patrí do skupiny 15 periodickej tabuľky na čele s dusíkom. Po bizmute (a Moskowium) je to najťažší prvok skupiny.
Je reprezentovaný chemickým symbolom SB. V prírode sa vyskytuje hlavne v Mineráloch Stabilit a Ullmannite, ktorých chemické vzorce sú SB2Siež3 a nisbs. Jeho vysoká tendencia tvoriť sulfidy namiesto oxidov je preto, že je chemicky mäkká.
 Kryštalický antimón. Zdroj: Najlepšie sci-FATCS [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Kryštalický antimón. Zdroj: Najlepšie sci-FATCS [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Na druhej strane, antimón je tiež fyzicky mäkký a na stupnici Mohs predstavuje tvrdosť 3. Je stabilný pri teplote miestnosti a nereaguje so vzduchovým kyslíkom. Ale keď sa zahrieva v prítomnosti kyslíka, tvorí trioxid antimón, SB2Ani3.
Je tiež odolný voči pôsobeniu slabých kyselín; Ale horúce je napadnuté kyselinami dusičnanov a hydrochlorovodíkovej.
Antimón má početné aplikácie, medzi nimi sa používa v zliatinách s olovom a cínu, pri výrobe batérií pre vozidlá, nízke trecie materiály atď.
Tento metaloid má zriedkavé vlastníctvo na zvýšenie objemu pri spevnení, čo umožňuje jeho zliatine úplne zaberať priestor použitý na formovanie prístroja, ktorý je potrebné na výrobu.
[TOC]
História vášho objavu
Bc
Existujú dôkazy, že od 3100 do.C, antimónový sulfid sa v Egypte použil ako kozmetika. V Mezopotámii, súčasnom Iraku, zvyšky vázy a ďalší artefakt, ktorý údajne dátum medzi 3000 a 2200 rokmi do.C, v ktorom sa použil vo svojom vypracovaní antimónov.
Zavedenie pojmu
Roman Erudito Plinio El Viejo (23-79 D.c) opísal použitie antimónu, ktorý nazval Estibio, pri vypracovaní siedmich liekov vo svojej zmluve o prírodných v histórii. Alchymista Abu Mussa Jahir Ibn Hayyan (721-815) sa pripisuje zavedeniu termínu Antimónia na vymenovanie prvku.
Ako synonymum na popieranie použil nasledujúcu etymológiu: „iba mono“. Potom chcel zdôrazniť, že antimón nebol v prírode sám. Už je známe, že je súčasťou minerálov síry, ktoré ako iné prvky.
Získanie
Predpokladá sa, že grécky naturista Pedanius Diascorides získava čistý antimón ohrievaním sulfidu antimónu vo vzduchom. Taliansky metalurgický Vannocio Biringucio, v knihe pyrotechniky (1540), robí opis metódy na izoláciu antimónu.
Nemecký chemik Andreas Libavius (1615) pomocou odliatnej zmesi železa, sulfidu antimónu, soľ a tartrato draselného dosiahol produkciu kryštalického antimónu.
Prvú podrobnú správu o Antimónoch v roku 1707 vytvorila francúzsky chemik Nicolas Lemery (1645-1715), vo svojej knihe ošetrenej na Antimón.
Môže vám slúžiť: chlorid meďnatého (i) (CUCL): Štruktúra, vlastnosti, použitiaKonštrukcia
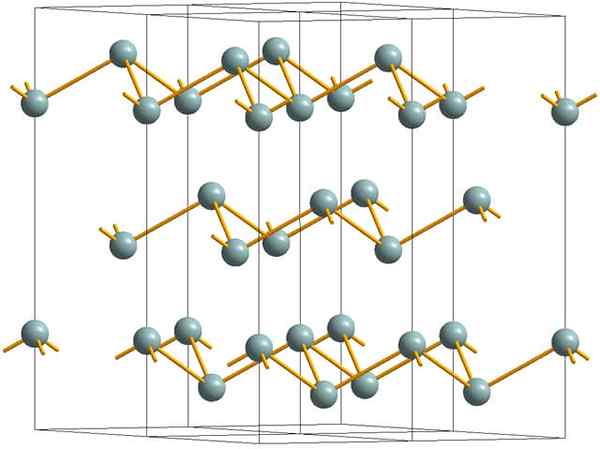 Pokrčené vrstvy, ktoré tvoria kryštalickú štruktúru kovového alebo strieborného antimónu. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Pokrčené vrstvy, ktoré tvoria kryštalickú štruktúru kovového alebo strieborného antimónu. Zdroj: Materialscientist [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Horný obrázok ukazuje štruktúru vrásokových vrstiev prijatých atómami arzénu. Túto štruktúru však prijíma aj sivastý antimón, známy ako kovový antimón. Hovorí sa, že je „pokrčený“, pretože existujú atómy SB, ktoré stúpajú a padajú z lietadla zloženého z vrstvy.
Tieto vrstvy, hoci sú zodpovedné za fotóny, ktoré s ním interagujú, aby žiarili strieborné trblietky, vďaka čomu sú antimón ako kov, pravdou je, že sily, ktoré ich zjednocujú, sú slabé; Odtiaľ až po zjavné kovové fragmenty SB sa dajú ľahko ukázať a sú krehké alebo tenisky.
Okrem toho, atómy SB v zvrásnených vrstvách nestačia na zoskupenie svojich atómových orbitálov a tak vytvárajú pás, ktorý umožňuje elektrické vedenie.
Vidíte sivú guľu individuálne, môžete vidieť, že má tri odkazy na SB-SB. Z vyššieho lietadla bolo možné vidieť SB v strede trojuholníka, pričom tri SB sa nachádzajú na vrcholoch. Trojuholník však nie je plochý a má dve úrovne alebo podlahy.
Bočná reprodukcia takýchto trojuholníkov a ich prepojenia vytvárajú zvrásnené vrstvy, ktoré sú zarovnané tak, aby tvorili rhomboébické kryštály.
Alotropia
Novo opísaná štruktúra zodpovedá sivej antimónu, najstabilnejšej zo svojich štyroch alotropov. Ostatné tri alotropy (čierne, žlté a výbušné) sú metastabilné; to znamená, že môžu existovať za veľmi prísnych podmienok.
Pokiaľ ide o jeho štruktúry, nie je príliš veľa informácií. Je však známe, že čierny antimón je amorfný, takže jeho štruktúra je chaotická a zložitá.
Žltý antimón je stabilný pod -90 ° C, správa sa ako nemetalický prvok a dá sa domnievať, že pozostáva z malých SB aglomerátov4 (podobné fosforu); Pri zahrievaní sa transformuje do čierneho alotrope.
A pokiaľ ide o výbušné antimón, pozostáva z želatínovej nádrže vytvorenej na katóde počas elektrolýzy vodného roztoku antimónu halogenidu.
Do najmenšieho silného trenia.
Vlastnosti
Atómová hmotnosť
121,76 g/mol.
Atómové číslo
51.
Elektronická konfigurácia
[KR] 4D105s25 P3.
Oxidačné stavy
-3, -2, -1, +1, +2, +3, +4, +5.
Fyzický popis
Lesklé striebro, krehký, skvamózny povrch, s modrým odtieňom. Môže sa tiež javiť ako čierny prach.
Bod topenia
630,63 ° C.
Bod varu
1.635 ° C.
Hustota
-6 697 g/cm3 pri izbovej teplote.
-6,53 g/cm3 V stave kvapaliny sa teplota rovná alebo väčšia ako bod topenia.
Fúzne teplo
19,79 kj/mol.
Odparovanie
193,43 kj/mol.
Môže vám slúžiť: Sulfid meďnatého: Štruktúra, vlastnosti, použitieMolárna kalikára
25,23 j/mol.Klimatizovať
Elektronegativita
2.05 (Pauling Scale).
Atómové rádio
140 hod.
Tvrdosť
Je to mäkký prvok s tvrdosťou 3 na stupnici Mohs a je možné ho poškriabať sklom.
Stabilita
Je stabilný pri izbovej teplote, nie je oxidáciou. Je tiež odolný voči kyslému útoku.
Izotopy
Má dve stabilné izotopy: 121Sb a 123SB. Okrem toho existuje 35 rádioaktívnych izotopov. Rádioaktívny izotop 125SB je ten, ktorý má najväčšiu polovicu života: 2,75 roka. Všeobecne platí, že rádioaktívne izotopy emitujú β žiarenie+ a p-.
Elektrická a tepelná vodivosť
Antimón je zlý vodič tepla a elektriny.
Chemická reaktivita
Nemôže vytlačiť vodík z zriedených kyselín. Iónový komplex s organickými a anorganickými kyselinami. Kovový antimón nereaguje so vzduchom, ale rýchlo sa premení na oxid na mokrý vzduch.
Halogény a sulfidy ľahko oxidujú antimón, ak sa proces vyskytuje pri vysokých teplotách.
Žiadosti
Zliatiny
Antimón sa používa v zliatine s olovom na vypracovanie dosiek pre automobilové batérie, zlepšuje odpor dosiek, ako aj charakteristiky zaťaženia.
Zliatina olovo a cínu sa používa na zlepšenie charakteristík zvarov, ako aj na odrazových guľkách a kaziet. Používa sa tiež v zliatinách na povlak elektrického kábla.
Antimón sa používa v protiútokových zliatinách, pri príprave zliatin na šupku a tvrdenie s nízkym obsahom cínu pri výrobe orgánov a iných hudobných nástrojov.
Pri kondenzácii predstavuje charakteristiku zdieľanú s vodou so zvyšujúcim sa objemom; Takže antimón prítomný v zliatinách s olovom a cínom vyplní všetky priestory foriem a zlepšuje definíciu štruktúr vyrobených z týchto zliatin.
Spomaľovač horenia
Antimónový oxid sa používa na vypracovanie zapaľovaných zlúčenín, vždy v kombinácii s halogénovanými spomaľovačmi ohňa, bromuros a chloridom.
Retardéry palesov môžu reagovať s kyslíkom a radikálnymi atómami OH, čo inhibuje oheň. Tieto zapaľovanie sa používajú v oblečení pre deti, hračky, lietadlá a na autosedačkách.
Pridajú sa tiež do polyesterových živíc a v komposovaní sklenených vlákien pre použité položky, ako napríklad kryt motorov ľahkých lietadiel.
Medzi antimónové zlúčeniny, ktoré sa používajú ako retardéry ohňa, patria: antimónový oxychlorid, SBOCL; Antimónový pentoxid, SBO5; Antimónový trichlorid, SBCL3; a antimónový oxid, SBO3.
Elektronika
Používa sa na výrobu polovodičov, diód, stredne infračervených detektorov a pri vypracovaní tranzitorov. Antimón s vysokou čistotou, používaný v polovodičovej technológii, sa získa redukciou antimónových zlúčenín s vodíkom.
Môže vám slúžiť: Faktory, ktoré ovplyvňujú rozpustnosťMedicína a veterinárny
Antimony zlúčeniny sa používajú v medicíne už od staroveku, ako sú Eméticas a Antiprotozoa. Tartrato draselný draselný (estetický kamenný) sa po dlhú dobu používal ako antisquisozomál; Používa sa tiež ako expektorant, diaforické a Emético.
Na kondicionovanie pokožky prežúvavcov zvierat sa používajú aj antimónové soli; ako je aniomalín a lítium a antimón Tiomalalát.
Meglumín Antimón je liek používaný pri liečbe leishmaniózy v vonkajších reflektoroch domácich zvierat. Aj keď boli terapeutické výhody vzácne.
Pigmenty a obrazy
Antimónové zlúčeniny sa používajú pri vypracovaní farieb a over. Používajú sa tiež v bermellónových, žltých a oranžových pigmentoch, ktoré sú produktmi pomalej oxidácie antimónov sulfidov.
Niektoré z jeho organických soli (Tartratos) sa používajú v textilnom priemysle na pomoc pri prepojení určitých farbív.
Antimónový sulfid sa použil v staroveku Egypta ako kozmetický v stmavení očí.
Iné použitia
Niektoré antimóny sa používajú ako povlaky na odstránenie mikroskopických bublín, ktoré sa tvoria na televíznych obrazovkách. Antimony ióny interagujú s kyslíkom a eliminujú ich tendenciu vytvárať bubliny.
Antimónový sulfid (III) sa používa v hlavách niektorých bezpečnostných zápasov. Antimónový sulfid sa používa aj na stabilizáciu koeficientu trenia materiálov používaných v automobilových brzdových doštičkách.
Izotop 124SB, spolu s beryliom, sa používa ako zdroj neutrónov s priemerom energie 24 keV. Antimón sa okrem toho používa ako katalyzátor v produkcii plastov.
Riziká
Je to krehký prvok, takže počas manipulácie sa môže vyskytnúť prášok znečisťujúcej látky v prostredí. U pracovníkov vystavených antimonymu prachu, dermatitíde, renalitídy, zápalu vysokých respiračných traktov a konjunktivitídy bola pozorovaná.
Pneumokonióza bola opísaná, niekedy kombinovaná s obštrukčnými zmenami pľúc, po predĺžených výstavách.
Antimónový oxid môže spôsobiť poškodenie fungovania srdca, ktoré môže byť smrteľné.
U ľudí vystavených tomuto prvku bola pozorovaná prítomnosť infekcií pustulárnej kože, prechodnej povahy.
Nepretržitý príjem s nízkou dávkou tohto kovu môže spôsobiť zvracanie hnačky a vredy žalúdka. Maximálna tolerovateľná koncentrácia vo vzduchu je tiež 0,5 mg/m3.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Zanedbaný. (11. marca 2009). Žltý antimón a výbušný antimón. Zdroj: Antimonyproperties.Blog.com
- Profesor. Ernst Cohen a J. C. Van den bosch. (1914). Alotropia antimónu. Postupy Royal Acad. Amsterdam. Zvuk. Xvii.
- Wikipedia. (2019). Antimón. Zdroj: In.Wikipedia.orgán
- Adameg, Inc. (2019). Antimón. Získané z: ChemistryExplaed.com
- Mc'oneal Sabre. (15. september 2018). Chémia: Vlastnosti a uplatňovanie SB-Antimony. Obnovené z: média.com
- « História biogeografie, aké štúdie a príklady výskumu
- Spudzovacie znečistenie príčiny, dôsledky, riešenia »

