Amín

- 4531
- 453
- Gabriel Bahna
Čo sú amíny?
Ten amín Sú to organické zlúčeniny odvodené z amoniaku. V nich sú kovalentné odbory medzi uhlíkom a dusíkom. Molekula dusíka je prirodzene kineticky inertná; Ale vďaka biologickej fixácii sa stáva amoniakom, ktorý zase trpí následnými alkylačnými reakciami.
Keď je amoniak „prenajatý“, nahrádza jeden, dva alebo tri z troch vodíkov atómami uhlíka. Tieto uhlíky môžu pochádzať z prenájmu (R) alebo aryl (AR). Existujú teda alifatické amíny (lineárne alebo rozvetvené) a aromatické.
Amíny sú silnejšie organické základne ako rovnaký amoniak. Sú ľahko odnímateľné z rastlinnej hmoty a vo všeobecnosti majú silné interakcie s neuronálnou matricou organizmov; Preto veľa liekov a liekov pozostáva z amínov s komplexnými štruktúrami a substituentmi.
Amínová štruktúra
 Všeobecný vzorec pre amín. Zdroj: Mache, Wikimedia Commons.
Všeobecný vzorec pre amín. Zdroj: Mache, Wikimedia Commons. Aj keď sa líši v závislosti od povahy r, elektronické prostredie atómu dusíka je rovnaké pre všetky z nich: tetraedrálne. Ale keďže pár elektrónov, ktoré sa nezdieľali na atóme dusíka (··), sa molekulárna geometria stáva pyramidálnym. Je to tak s amoniakom a aminami.
Aminas môže byť reprezentovaný tetrahedronom, ako aj s uhlíkovými zlúčeninami. Teda NH3 a Ch4 Sú nakreslené ako tetraedra, kde sa pár (··) nachádza v jednom z vrcholov nad dusík.
Obe molekuly sú akvirálne; Začnú však prezentovať chiralitu, keď ich H nahrádza. Amina r2NH je Aquiral, ak sú dve R iné. Chýba mu však žiadna konfigurácia na rozlíšenie enantioméru od iného (ako sa to stáva s chirálnymi uhlíkovými centrami).
Je to preto, že enantioméry:
R2N-H | H-nr2
Vymieňajú sa rýchlosťou tak, že sa nemôže izolovať; a preto sa štruktúry amínov považujú.
Amínové vlastnosti
Polarita
Amíny sú polárne zlúčeniny, pretože skupina Amino NH2, Za atóm voliteľného dusíka, prispieva k dipólovému momentu molekuly. Všimnite si, že dusík má schopnosť darovať vodíkové väzby, ktoré majú vo všeobecnosti vysoké body varu a fúzne.
Fyzicka charakteristika
Vo svete chémie, keď hovoríme o amíne, vzniká nedobrovoľný čin zakrytia nosa. Je to preto, že vo všeobecnosti majú zvyčajne nepríjemné pachy, z ktorých niektoré sa javia ako z zhnitých rýb.
Môže vám slúžiť: Maillardova reakciaOkrem toho majú tekuté amíny zvyčajne žltkasté odtiene, ktoré zvyšujú vizuálnu nedôveru, ktorú vytvárajú.
Rozpustnosť
Amíny majú tendenciu byť nerozpustné vo vode, pretože napriek tomu, že sú schopné tvoriť vodíkové mosty s H₂o, jeho väčšinová organická zložka je hydrofóbna. Čím objemnejšie alebo dlhé skupiny R, tým menej bude ich rozpustnosť vo vode.
Ak je v strede kyselina, rozpustnosť sa však zvyšuje tvorbou toho, čo je známe ako amínové soli. V nich má dusík pozitívne čiastočné zaťaženie, ktoré priťahuje elektrostaticky na bázu aniónu alebo kyseliny konjugátu.
Základnosť
Amíny sú silnejšie organické základne ako amoniak. Čím väčšia je elektronická hustota okolo atómu dusíka, tým viac bude základná; to znamená, že kyseliny média budú rýchlejšie nechránené. Ak je amín veľmi základný, môže dokonca chytiť protón z alkoholov.
Typy (primárne, sekundárne, terciárne)
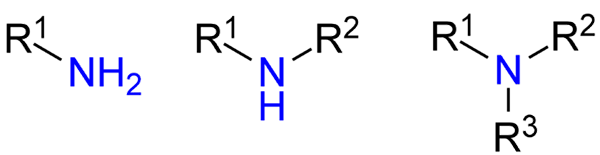 Typy amínov. Zdroj: Jü cez Wikipedia.
Typy amínov. Zdroj: Jü cez Wikipedia. Aj keď neboli formálne prezentované, odkazoval sa na primárne, sekundárne a terciárne amíny (horný obrázok zľava doprava).
Primárne amíny (RNH2) sú Monosustuidas; Sekundárne (r2NH) sú rozpustené, s dvoma r alkomilovými alebo arylovými skupinami; a terciárny (r3N), sú trisustuid a chýba mu vodík.
Všetky existujúce amíny sú odvodené z týchto troch typov, takže ich rozmanitosť a interakcie s biologickou a neuronálnou matricou sú obrovské.
Vo všeobecnosti by sa dalo očakávať, že terciárne amíny budú najzákladnejšie; Takéto vyhlásenie však nie je možné urobiť bez toho, aby som poznal štruktúry R.
Tvorba amín
Alkylácia amoniaku
Spočiatku sa uvádza, že amíny pochádzajú z amoniaku; Preto najjednoduchší spôsob, ako ich vytvoriť, je prostredníctvom ich alkylácie. Za týmto účelom sa prebytok amoniaku reaguje s alkylhalogenidom, po ktorom nasleduje pridanie bázy na neutralizáciu amínovej soli:
NH3 + Rx => rnh3+X- => Rnh2
Všimnite si, že tieto kroky vedú k primárnej Amine. Môže sa tiež vytvoriť sekundárne a dokonca terciárne amíny, takže výkon pre jeden produkt klesá.
Niektoré metódy výcviku, ako napríklad Gabrielova syntéza, umožňujú získať primárne amíny tak, aby sa nevytvorili iné nežiaduce výrobky.
Môže vám slúžiť: etylalkohol: štruktúra, vlastnosti, použitie, získaniePodobne môžu byť ketóny a aldehydy redukované v prítomnosti amoniaku a primárnych amínov, aby sa vznikli sekundárnym a terciárnym amínom.
Katalytická hydrogenácia
Nitro zlúčeniny sa môžu znížiť v prítomnosti vodíka a katalyzátora na transformáciu do ich zodpovedajúcich amínov.
Arno2 => Rnah2
Nitrilos, rc≡n a Amidas, rconr2, Sú tiež redukované tak, aby poskytovali primárne a terciárne amíny.
Menovanie
Ako sú pomenované amíny? Väčšinu času sú pomenovaní podľa R, Aquilo alebo aryl Group. K menovi R, odvodené z jeho alkáne, sa k nemu nakoniec pridá slovo „amine“.
Teda3Chvály2Chvály2NH2 Je to publimín. Na druhej strane môže byť vymenovaný iba za alkane a nie ako skupina R: propanamín.
Prvý spôsob, ako ich pomenovať, je rovnako známy a použitý.
Keď sú dve skupiny NH2, Alkane je vymenovaný a sú uvedené pozície aminoskupín. Teda h2Nch2Chvály2Chvály2Chvály2NH2 Volá sa: 1,4-butanodiamín.
Ak existujú okysličené skupiny, ako napríklad OH, NH by sa mala prednosť prioritovať2, ktorý sa stáva menovaným za substituent. Napríklad Hoch2Chvály2Chvály2NH2 sa volá: 3-aminopropanol.
A pokiaľ ide o sekundárne a terciárne amíny, n písmená sú vyrobené tak, aby označili skupiny R. Najdlhší reťazec si zachová názov zlúčeniny. Tak, Cho3Nhch2Chvály3 Volá sa: n-metyletylamín.
Použitie amín
Farbivá
Primárne aromatické amíny môžu slúžiť ako východiskový materiál pre syntézu azo farbív. Amíny spočiatku reagujú na vytvorenie diazóniových solí, ktoré tvoria zlúčeniny kopuláciou strechy (alebo diazoickej väzby).
Vzhľadom na intenzívny sfarbenie sa používajú v textilnom priemysle ako farbenie materiálu; Napríklad: metyl oranžová, hnedá 138 priama, žltá západ slnka FCF a Ponceau.
Drogy a drogy
Mnoho liekov pôsobí s agonistami a antagonistami prírodných amínových neurotransmiterov. Príklady:
-Chlorofeniramín je antihistamín používaný pri kontrole alergických procesov v dôsledku príjmu niektorých potravín, sennej horúčky, bodnutia hmyzu atď.
-Chlorpromazín je sedatívne činidlo, nie spánkový induktor. Zmierňuje úzkosť a dokonca sa používa pri liečbe niektorých duševných porúch.
-Efedrín a fenymfedrín sa používajú ako dekongestanty respiračného traktu.
Môže vám slúžiť: osmolarita-Amitriptalín a imipramín sú terciárne amíny, ktoré sa používajú pri liečbe depresie. Tricyklický antidepresívny kužeľ je klasifikovaný podľa ich štruktúry.
-Opioidné analgetiká, ako je morfín, kodelín a heroín, sú terciárne amíny.
Ošetrenie plynu
Pri eliminácii plynov oxidu uhličitého (CO) sa používa niekoľko amínov vrátane diglykolamínu (DGA) a dietolamínu (DEA) (CO (CO2) a sulfid vodíka (h2S) prítomné v zemnom plyne a rafinériách.
Poľnohospodárska chémia
Metilamíny sú sprostredkovateľské zlúčeniny v syntéze chemikálií používaných v poľnohospodárstve, ako sú herbicídy, fungicídy, insekticídy a biocídy.
Výroba živicí
Metilamíny sa používajú počas vypracovania výmenných živíc iónov, použiteľné pri deionizácii vody.
Živiny zvierat
Trimetylamín (TMA) sa používa predovšetkým pri výrobe chloridu chloridu, doplnku vitamínu B používaného v kurčatách, morkách a ošípaných.
Priemysel
Olej dimetylamínu (DMA) je emulgátorom na použitie pri výrobe syntetickej gumy. DMA sa používa priamo ako polymerizačný modifikátor v parnej fáze butadiénu a ako stabilizátor latexu prírodného gumy namiesto amoniaku namiesto amoniaku
Rozpúšťadlo
Na syntézu polárnych polárnych rozpúšťadiel timetylamínu (DMA) a monometylamín (MMA), dimetylacetamidu (DMAC) a N-metylpirrolidón (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP) (NMP).
Medzi aplikácie DMF patrí: uretánový povlak, rozpúšťadlo akrylovej priadze, reakčné rozpúšťadlá a extrakčné rozpúšťadlá.
DMAC sa používa pri výrobe farbív a rozpúšťadla priadze. Nakoniec sa NMP používa pri rafinácii mazivých olejov, snímača a skloviny.
Príklady amínov
Kokaín
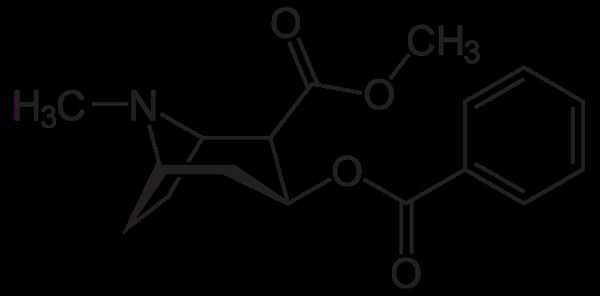 Molekula kokaínu. Neurotokeker, Wikimedia Commons
Molekula kokaínu. Neurotokeker, Wikimedia Commons Kokaín sa používa ako lokálny anestetikum pri určitých typoch operácie očí, uší a hrdla. Ako je vidieť, je to terciárny amín.
Nikotín
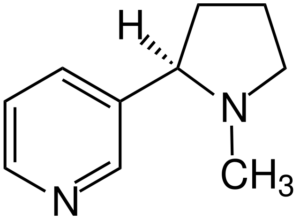 Nikotín. Zdroj: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons
Nikotín. Zdroj: Jü [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons Nikotín je primárnym činidlom závislosti na tabaku a chemicky terciárny amín. Nikotín prítomný v tabakovom dyme sa rýchlo absorbuje a je vysoko toxický.
Morfín
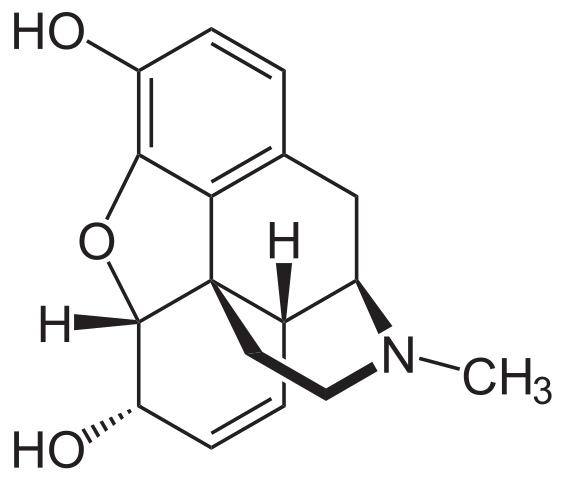 Molekula morfínu. Zdroj: Neurotoger [verejná doména], z Wikimedia Commons
Molekula morfínu. Zdroj: Neurotoger [verejná doména], z Wikimedia Commons Je to jeden z najúčinnejších analgetík na zmiernenie bolesti, najmä rakovina. Je to opäť terciárny amín.
Serotonín
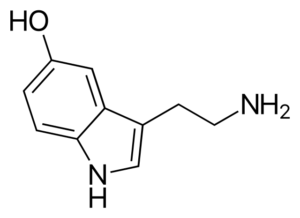 Molekula serotonínu. Zdroj: Harbin [verejná doména], z Wikimedia Commons
Molekula serotonínu. Zdroj: Harbin [verejná doména], z Wikimedia Commons Serotonín je amínové neurotransmiter. U depresívnych pacientov je koncentrácia hlavného metabolitu serotonínu znížená. Na rozdiel od ostatných amínov je to primárne.
Odkazy
- Metylamíny: Použitie a aplikácie. Získané z: Chemours.com
- Prieskum trhu s transparentnosťou. (s.F.). Aminy: Dôležité fakty a použitie. Získané z: TransparencyMarTresearch.com

