Etylacetát
- 766
- 33
- Valentín Dula
On etyl alebo etylitín acetát Je to organická zlúčenina, ktorej chemický vzorec je Cho3Cooc2H5. Skladá sa z esteru, kde alkoholická zložka odvodzuje z etanolu, zatiaľ čo jej zložka kyseliny karboxylovej pochádza z kyseliny octovej.
Je to kvapalina za normálnych podmienok teploty a tlaku, ktorá predstavuje arómu príjemnú pre ovocie. Táto vlastnosť vstupuje dokonale v harmónii, takže sa očakáva od esteru; čo je v skutočnosti chemická povaha etylacetátu. Z tohto dôvodu nachádza použitie v potravinárskych výrobkoch a alkoholických nápojoch.
 Etylacetát. Zdroj: Commons Wikimedia.
Etylacetát. Zdroj: Commons Wikimedia. Horný obrázok ukazuje štruktúru kostry etylacetatód. Všimnite si svoju zložku kyseliny karboxylovej a napravo na alkoholickú zložku. Zo štrukturálneho hľadiska sa dá očakávať, že sa táto zlúčenina bude správať ako hybrid medzi octom a alkoholom; Vykazuje však svoje vlastné vlastnosti.
To je miesto, kde takéto hybridy nazývané estery vynikajú iným. Etylacetát nemôže reagovať ako kyselina ani dehydrát z neprítomnosti skupiny OH. Namiesto toho trpí základnou hydrolýzou v prítomnosti silnej bázy, ako je hydroxid sodný, NaOH.
Táto hydrolytická reakcia sa používa vo výučbových laboratóriách pre chemické kinetické experimenty; kde je reakcia navyše druhá objednávka. Keď dôjde k hydrolýze, Ethilov etanoát.
Vo svojej štrukturálnej kostre sa pozoruje, že atómy vodíka na kyslíku prevládajú. To ovplyvňuje jeho schopnosť interagovať s nie tak polárnymi druhmi ako tuky. Používa sa tiež na rozpustenie zlúčenín, ako sú živice, farbivá a všeobecne organické tuhé látky.
Napriek tomu, že má príjemnú arómu, predĺžená expozícia tejto tekutine vytvára negatívny náraz (ako takmer všetky chemické zlúčeniny) na telo.
Etylacetát štruktúra
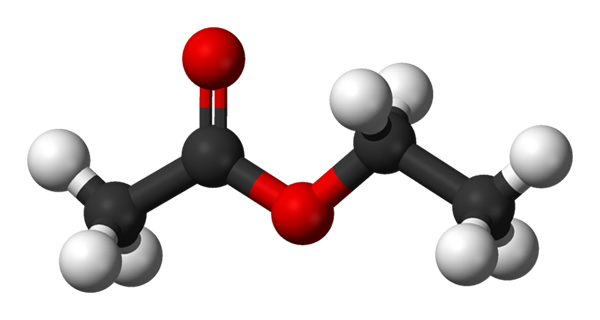
 Model guľôčok a stĺpcov pre etylacetát. Zdroj: Benjah-Bmm27 [verejná doména]
Model guľôčok a stĺpcov pre etylacetát. Zdroj: Benjah-Bmm27 [verejná doména] Horný obrázok ukazuje štruktúru etylacetátu s modelom guľôčok a tyčí. V tomto modeli sú zvýraznené atómy kyslíka s červenými guľami; Vľavo je frakcia odvodená z kyseliny a napravo je frakcia odvodená od alkoholu (Alcoxi, -alebo).
Môže vám slúžiť: slabé elektrolyty: koncept, charakteristiky, príkladyKarbonylovú skupinu je možné vidieť pomocou odkazu C = o (dvojité stĺpce). Štruktúra okolo tejto skupiny a susedný kyslík je plochý, pretože dochádza k premiestneniu rezonančnej záťaže medzi oba kyslík; Skutočnosť, ktorá vysvetľuje relatívne nízku kyslosť adrogénov a hydrogénov (tie zo skupiny -ch3, spojené s c = o).
Molekula, ktorá otáča dve zo svojich odkazov, priamo uprednostňuje, ako interaguje s inými molekulami. Prítomnosť dvoch atómov kyslíka a asymetria v štruktúre jej dodáva trvalý dipólový moment; čo je zase zodpovedné za svoje interakcie dipólov-dipól.
Napríklad elektronická hustota je väčšia v blízkosti dvoch atómov kyslíka, čo v skupine -ch značne klesá3, A postupne v OCH Group2Chvály3.
V dôsledku týchto interakcií tvoria etylacetátové molekuly kvapalinu za normálnych podmienok, ktorá má výrazne vysoký bod varu (77 ° C).
Absencia atómov Darcovia vodíkových mostov
Ak je štruktúra starostlivo pozorovaná, bude si všimnúť neprítomnosť atómu schopného darovať vodíkový most. Atómy kyslíka sú však akceptormi takýchto a etylacetát je veľmi rozpustný vo vode a interaguje v odhadovanom stupni s polárnymi zlúčeninami a darcami vodíkových mostov (napríklad cukry).
Umožňuje vám tiež vynikajúco interagovať s etanolom; Dôvod, prečo jeho prítomnosť v alkoholických nápojoch nie je prekvapená.
Na druhej strane jeho skupina Alcoxi ho robí schopná interagovať s určitými apolárnymi zlúčeninami, ako je chloroforma, chloroforma, chloroforma, chloroforma, chloroforma3Cl.
Fyzikálne a chemické vlastnosti
Mená
-Etylacetát
-Etylotán
-Octový etyl
-Acetoxietano
Molekulárna receptúra
C4H8Ani2 alebo CH3Cooc2H5
Molekulová hmotnosť
88,106 g/mol.
Fyzický popis
Číra bezfarebná tekutina.
Farba
Bezfarebná tekutina.
Vôňa
Charakteristika éterov, podobná vône ananásu.
Príchuť
Pekné, keď sa zriedi, prináša do piva ovocnú príchuť.
Prah
3,9 ppm. 0,0196 mg/m3 (nízka vôňa); 665 mg/m3 (Vysoká vôňa).
Môže vám slúžiť: Chemická väzbaOdpojatá vôňa pri 7 - 50 ppm (priemer = 8 ppm).
Bod varu
171 ° F pri 760 mmHg (77,1 ° C).
Bod topenia
-118,5 ° F (-83,8 ° C).
Rozpustnosť
80 g/l.
Rozpustnosť v organických rozpúšťadlách
Misilné s etanolom a etyléterom. Veľmi rozpustný v acetóne a benzéne. Misilné s chloroformom, fixnými olejmi a prchavým a tiež s okysličenými a chlórovanými rozpúšťadlami.
Hustota
0,9003 g/cm3.
Hustota pary
3,04 (vo vzťahu vzduchu: 1).
Stabilita
Pomaly sa rozkladá s vlhkosťou; nezlučiteľné s niekoľkými silnými oxidačnými plastmi a agentmi. Zmes s vodou môže byť výbušná.
Tlak vodnej pary
93,2 mmHg pri 25 ° C
Hrebeň
0,423 mPoise pri 25 ° C.
Spaľovacie teplo
2.238,1 kj/mol.
Odparovanie
35,60 kJ/mol pri 25 ° C.
Povrchové napätie
24 Dynas/cm pri 20 ° C.
Index lomu
1 373 až 20 ° C/D.
Úložisko
2 - 8 ° C.
Pka
16 - 18 až 25 ° C.
Syntéza
Reakcia rybolovu
Etylacetát je priemyselne syntetizovaný Fisherovou reakciou, v ktorej je etanol esterifikovaný kyselinou octovou. Reakcia sa vykonáva pri izbovej teplote.
Chvály3Chvály2Oh +ch3Cooh CH3Kočiary2Chvály3 + H2Ani
Reakcia je zrýchlená kyslou katalýzou. Rovnováha sa pohybuje doprava, to znamená smerom k výrobe etylacetátu odstránením vody; Podľa zákona o hromadnej akcii.
Reakcia Tishchenko
Etylacetát sa tiež pripravuje priemyselne s použitím reakcie Tishchenko, ktorá spája dva ekvivalenty acetaldehydu s použitím katalyzátora ako katalyzátora.
2 ch3Cho => Cho3Kočiary2Chvály3
Iné metódy
-Etylacetát sa syntetizuje ako ko -produkt pri oxidácii butánu na kyselinu octovú, pri reakcii pri teplote 175 ° C a 50 atm. Používa sa ako kobaltový katalyzátor a chrómové ióny.
-Etylacetát je ko -produkt polyvinyllyvinylacelátu etanolyoly.
-Etylacetát sa tiež vyrába v priemysle dehydrogenáciou etanolu, katalyzuje reakciu pomocou medi pri vysokej teplote, ale menej ako 250 ° C.
Žiadosti
Solventný
Etylacetát sa používa ako rozpúšťadlo a riedenie pomocou čistenia dosiek s obvodmi. Používa sa ako rozpúšťadlo pri výrobe extraktu z modifikovaného chmeľu a v kávovej kávu a čajových listoch. Používa sa v atramentoch používaných na označenie ovocia a zeleniny.
Môže vám slúžiť: kyselina cyanhydrová: molekulárna štruktúra, vlastnosti, používaEtylacetát sa používa v textilnom priemysle ako čistiaci prostriedok. Sa používa pri kalibrácii teplomerov, používaných pri separácii cukrov. V lakovnom priemysle sa používa ako rozpúšťadlo a riedidlo použitých materiálov.
Umelé príchute
Používa sa pri vypracovaní ovocných príchutí; Napríklad: banán, hruška, broskyňa a ananás, ako aj v hroznovej aróme atď.
Analytika
Používa sa na stanovenie bizmutu, bóru, zlata, molybdénu a platiny, ako aj rozpúšťadla talia. Etylacetát má schopnosť extrahovať mnoho zlúčenín a prvkov prítomných vo vodnom roztoku, ako je: fosfor, kobalt, volfrám a arzén.
Organická syntéza
Etylacetát sa v priemysle používa ako reduktor viskozity živicových živicových látok vo fotorestonovacích formuláciách. Používa sa na produkciu acetamidu, acetylcetát a metyl -heptanón.
Chromatografia
V laboratóriách sa etylacetát používa ako mobilná fáza chromatografie v stĺpcoch a ako extrakčný rozpúšťadlo. Mať etylacetát je relatívne nízky bod varu, je ľahké sa odparovať, čo vám umožňuje sústrediť rozpustené látky v rozpúšťadle.
Entomológia
Etylacetát sa používa v entomológii na udusenie hmyzu umiestneného v nádobe, čo umožňuje jeho zber a štúdium. Vary etylacetátu zabíjajú hmyz bez toho, aby ho zničili a vyhýbali sa ich tvrdeniu, čo uľahčuje zostavu zberu.
Riziká
-LDpäťdesiat Z etylacetátu u potkanov to naznačuje nízka toxicita. Môže však dráždiť pokožku, oči, pokožku, nos a hrdlo.
-Vystavenie vysokým úrovniam môže spôsobiť závraty a mdloby. Podobne, dlhodobá expozícia môže ovplyvniť pečeň a obličky.
-Inhalácia etylacetátu pri koncentrácii 20.000 - 43.000 ppm, môže produkovať pľúcny edém a krvácanie.
-Limit výstavy práce bol stanovený OSHA pri 400 ppm vo vzduchu, v priemere počas 8 -hodinovej pracovnej zmeny.
Odkazy
- Ilustrovaný glosár organickej chémie: ethylacetát (ETOAC). Získané z: Chem.UCLA.Edu
- Ethylacetát. Zdroj: CHM.Štrbina.Ac.Uk

