Alkény
- 1360
- 12
- Tomáš Klapka
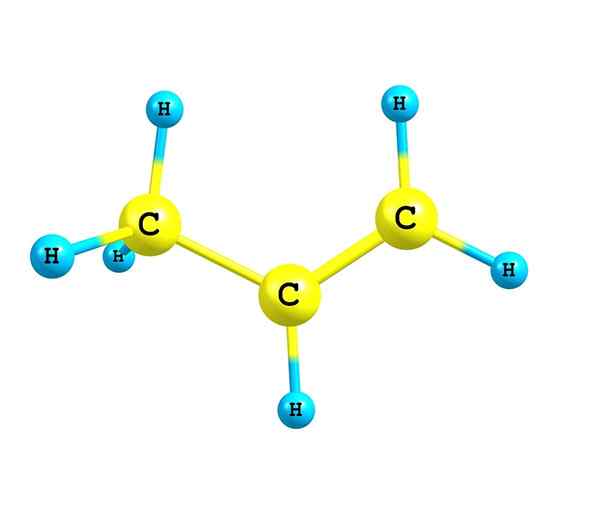
 Alkény alebo olefíny sú nenasýtené uhľovodíky, ktoré majú v štruktúre aspoň dvojitú väzbu z uhlíka a uhlíka
Alkény alebo olefíny sú nenasýtené uhľovodíky, ktoré majú v štruktúre aspoň dvojitú väzbu z uhlíka a uhlíka Čo sú alkénov?
Ten alkény alebo olefíny Sú to nenasýtené uhľovodíky, ktoré majú v štruktúre aspoň dvojitú väzbu. Nazývajú sa olefíny kvôli schopnosti Etene alebo etylénu reagovať s halogénmi na výrobu oleja alebo oleja. V súčasnosti sa termín olefinas nepoužíva a tieto zlúčeniny sa teraz nazývajú alkény.
Fyzikálne vlastnosti alkénov sú ovplyvňované ich molekulovou hmotnosťou, ako aj ich sýteným kostrom. Napríklad alkény s 2 až 4 uhlíkmi (Buteno etene) sú plyny. S 5 až 18 atómami uhlíka v dlhom reťazci sú kvapalné. Zatiaľ čo alkény s viac ako 18 atómami uhlíka sú pevné.
Prítomnosť dvojitej väzby poskytuje veľkú reaktivitu, a tak zažíva mnoho chemických reakcií, ako je pridanie, eliminácia, hydrogenácia, hydratácia a polymerizácia, ktoré jej umožňujú vytvárať početné použitie a aplikácie.
Alkény sa vyrábajú priemyselne tepelným krakovaním vysokej molekulovej hmotnosti (parafínové vosky); Katalytická dehydrogenácia a dehydrocloklinácia chlorácie.
Chemická štruktúra alkénov
 Zdroj: Self Made
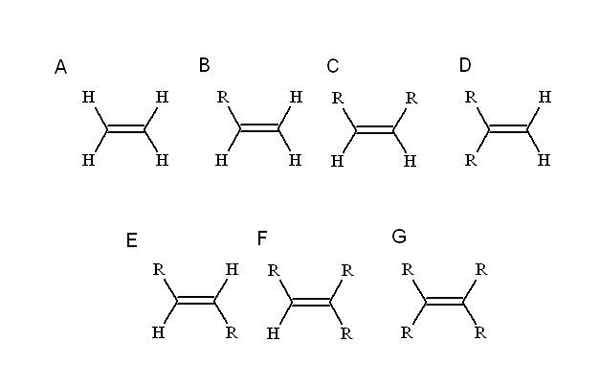
Zdroj: Self Made Alkény sa vyznačujú tým, že majú vo svojej štruktúre jedno alebo viac dvojitých odkazov. Toto je znázornené ako c = c, ktoré majú oba atómy uhlíka a hybridizáciu SP2.
Preto je región reťazca, kde je dvojitá väzba alebo nenasýtenie, je plochá. Je tiež záslužníkom zdôrazniť, že dva uhlíky môžu byť spojené s dvoma ďalšími substituentmi (alebo skupinami).
Ktoré substituenty? Každý, kto nahrádza jeden z najjednoduchších alketénových vodíkov: etylén (alebo eteno). Začínajúc od neho (a, vynikajúci obraz) r, ktorý je alquilickým substituentom, zaberá miesto jedného zo štyroch vodínov, ktoré spôsobí mono-substitutný alkén (b).
Doteraz, bez ohľadu na to, ktorý vodík je nahradený, identita B sa nezmení. To znamená, že mu chýbajú stereoizoméry zložené z rovnakých chemických vzorcov, ale s inou priestorovou dispozíciou jeho atómov.
Môže vám slúžiť: bod rovnocennostiStereoizoméry
Keď je druhý vodík nahradený ďalším R, ako v C, teraz stereoizoméry C, D a E. Je to preto, že priestorové orientácie, pokiaľ ide o obidve r, sa môžu meniť a používať sa navzájom, cis-trans alebo priradenia E-Z.
V C, DI-Substitute alkene môžu byť dva R reťazce akejkoľvek dĺžky alebo nejaké heteroátomo. Jeden je v prednej polohe vo vzťahu k druhej. Ak sa tieto dve r pozostávajú z toho istého substituenta, napríklad, potom C je stereoizomérový cis.
V D sú obe skupiny R ešte bližšie, pretože sú spojené s rovnakým atómom uhlíka. Toto je geminálny stereoizomér, hoci je viac ako stereoizomér, je to v skutočnosti koncová dvojitá väzba, to znamená, že je na konci alebo princípe reťazca (z tohto dôvodu má dva vodné hydrogény druhý uhlík).
A v E, najstabilnejších stereoizoméroch (alebo geometrických izoméroch), sú dve skupiny R oddelené väčšou vzdialenosťou, ktorá prechádza diagonálom dvojitého väzby. Prečo je najstabilnejší? Je to preto, že keďže je priestorové oddelenie medzi nimi väčšie, takže medzi nimi nie je žiadne sestry.
Na druhej strane, F a G sú alkény natiahnuté tri- a Tetra. Opäť nie sú schopní vygenerovať žiadny stereoizomér.
Fyzikálne a chemické vlastnosti alkénov
Rozpustnosť
Sú nemiešateľné s vodou kvôli svojej nízkej polarite. Ale rozpúšťajú sa v organických rozpúšťadlách.
Fúzne body pri ° C
Etano -169, propeno -185, 1 -pentín -165, 1 -hepteno -119, 3 -oktein
-101,9, 3 -None -81,4 a 5 -dechenum -66,3.
Bod varu v ° C
Etano -104, propeno -47, trans2buteno 0,9, cis2buteno 3,7, 1-penten 30, 1-hepteno 115, 3-ok 122, 3-noneno 147 a 5-decenday.
Môže vám slúžiť: laboratórny filter): Charakteristiky, funkcie, typyBod varu sa zvyšuje priamy vzťah k počtu alkénových uhlíkov. Na druhej strane, tým viac rozvetvená jej štruktúra, najslabšie sú jej intermolekulárne interakcie, ktoré sa odrážajú v znížení vriaceho alebo fúzneho bodu.
Hustota
Etano 0,6128 mg/ml, propeno 0,6142 mg/ml a 1-butén 0,6356 mg/ml, 1-pente 0,64 mg/ml a 1-hexen 0,673.
V alkénoch je maximálna hustota 0,80 mg/ml. To znamená, že sú menej husté ako voda.
Polarita
Závisí to od chemickej štruktúry, substitúcií a prítomnosti iných funkčných skupín. Alkény majú dipmers, teda izomér 2-buténu cis.
Alkénska reaktivita
Alkény majú veľkú kapacitu reagovať kvôli dvojitým odkazom, ktoré majú. Medzi príslušné reakcie patria: pridanie, eliminácia, výmena, hydrogenácia, hydratácia a polymerizácia.
Reakcia na pridanie
H2C = ch2 + Cl2 => Clch2-CclH2 (etylén dichlorid)
Hydrogenačná reakcia
Vyskytuje sa pri vysokých teplotách a v prítomnosti adekvátnych katalyzátorov (PT, PD alebo jemne rozdelené)
Chvály2= CH2 + H2 => Ch3-Chvály3 (Etano)
Hydratačná reakcia
Reakcia, ktorá je zdrojom tvorby alkoholu z ropných derivátov:
H2C = ch2 + H2O => h3C-C-CH2Oh (etylalkohol)
Polymerizačné reakcie
Etylén v prítomnosti katalyzátorov, ako je hliníkový pokus a polymeriza tetrachloridu titánu v polyetyléne, ktorý obsahuje asi 800 atómov uhlíka. Tento typ polyméru sa nazýva pridaný polymér.
Použitia a aplikácie alkénov
Polyméry
- Polyetylén s nízkou hustotou sa používa pri výrobe vriec, skleníkových plastov, balenia, riadu, plavidiel atď. Zatiaľ čo vysoká hustota je pevnejšia a mechanicky odolnejšia, pri výrobe škatúľ, nábytku, ochrancov, ako sú prilby a kolená, hračky a palety.
- Polpropylén, propylénový polymér, sa používa pri vypracovaní kontajnerov, listov, laboratórnych zariadení, hračiek, obalových filmov, vlákien Sogas, čalúnenia a kobercov.
- Polyvinylchlorid (PVC) je polymér vinylchloridu, ktorý sa používa pri výrobe skúmaviek, dlaždíc pre podlahy, kanály, dvere a rámy okien atď.
- Polybutadién, polymér 1,3-butadiénu, je určený na výrobu ložiskových pásov, hadíc a pásov vozidiel, ako aj na povlak kovových plechoviek.
- Kopolyméry etylénu a propylénu sa používajú pri výrobe hadíc, tela a častí podvozku pre textil atď.
Alkény
- Používajú sa pri získavaní rozpúšťadiel, ako je etylénglykol a dioxán. Etylénglykol sa používa ako nemrznúca zmes v autách radiátoroch.
- Etylén je hormón rastlín, ktorý riadi jej rast, klíčenie semien a vývoj ovocia. Preto sa používa na vyvolanie dozrievania banánov, keď sa dostanú do cieľa.
- Používajú sa ako surovina na výrobu mnohých zlúčenín, ako sú alkylové halogenidy, etylénoxid a najmä etanol. Používajú tiež v priemysle, osobnej starostlivosti a medicíne.
- Používajú sa pri získavaní a výrobe lakov, detergentov, aldehydov a palív. 1,3-butadieno sa používa ako surovina pri výrobe syntetických gumov.
Odkazy
- Chémia. Fyzické vlastnosti alkénov. Zobraté z: pridelenie chémie.com
- Wikipedia. (2018). Alkén. Prevzaté z: v.Wikipedia.orgán
- Chémia librettexts. Fyzické vlastnosti alkénov. Prevzaté z: chem.Librettexts.orgán
- Whitten, Davis, Peck & Stanley. Chémia. (8. vydanie.). Učenie sa.
- Francis a. Korytnačka. Organická chémia. (Šieste vydanie., Strana 194). MC Graw Hill.
- Houchton Mifflin Harcourt. (2016). Alkény: molekulárne a štrukturálne vzorce. Prevzaté z: Cliffsnotes.com
- Chipera, angie. (25. apríla 2017). Čo je olefín v chémii? Vedecký. Prevzaté z: vedec.com

