Alfa amilasa Charakteristiky, štruktúra, funkcie
- 2810
- 514
- MUDr. Žigmund Boška
Ten Alfa Amilasa (a-amyláza) je amilolitický enzým skupiny Endo Amilasas, ktorý je zodpovedný za hydrolýzu väzieb a-1,4 medzi zvyškami glukózy, ktoré tvoria rôzne typy uhľohydrátov v prírode.
Systematicky známy ako systematicky známy ako a-1,4-glukán. Napríklad u ľudí sú amylázy prítomné v slinách a tie, ktoré vylučujú pankreas.
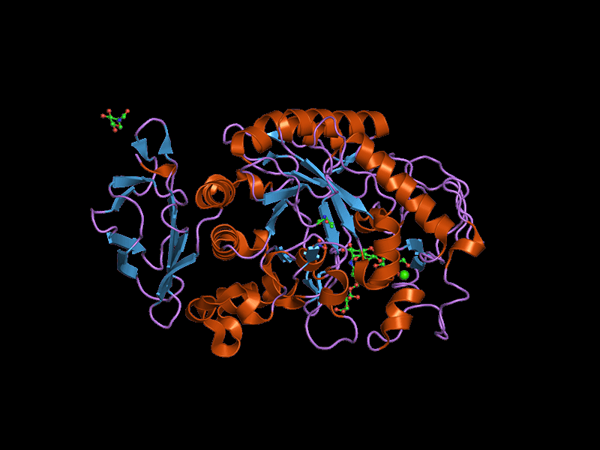
 Štruktúra C-terminálnej domény zvieraťa Alfa Amilasa (Zdroj: Jawahar Swaminathan a MSD zamestnanci v Európskom bioinformatickom inštitúte [verejná doména] cez Wikimedia Commons) prostredníctvom Wikimedia Commons)
Štruktúra C-terminálnej domény zvieraťa Alfa Amilasa (Zdroj: Jawahar Swaminathan a MSD zamestnanci v Európskom bioinformatickom inštitúte [verejná doména] cez Wikimedia Commons) prostredníctvom Wikimedia Commons) Kuhn, v roku 1925, bol prvým, kto minil pojem „a-amyláza“ na základe skutočnosti, že produkty hydrolýzy, ktoré katalyzujú tieto enzýmy, majú konfiguráciu a. Neskôr, v roku 1968 sa zistilo, že tieto výhodne pôsobia na lineárne a neoceniteľné konfiguračné substráty konfigurácie.
Rovnako ako iné amilolitické enzýmy, aj a-amyláza je zodpovedná za hydrolýzu škrobu a ďalšie príbuzné molekuly, ako je glykogén, čo produkuje menšie polyméry zložené z opakovaných jednotiek glukózy.
Okrem fyziologických funkcií, ktoré má tento enzým u zvierat, rastlín a mikroorganizmov, ktoré ich exprimujú, a-amyláza, spolu s ostatnými triedami existujúcich amyláz, predstavujú 25% enzýmov používaných na priemyselné a biotechnologické účely súčasný trhový trh súčasný trh.
Mnoho druhov húb a baktérií je hlavným zdrojom získania a-amyláz, ktoré sa používajú častejšie v priemysle a vedeckom experimente. Je to hlavne kvôli jeho všestrannosti, jeho ľahkému získaniu, jednoduchému riadeniu a nízkym nákladom súvisiacim s jeho výrobou.
[TOC]
Charakteristika
A-amylázy nájdené v prírode môžu mať pre svoju prevádzku optimálne rozsahy pH veľmi odlišného pH; Napríklad optimálne pre a-amylázy zvieratá a rastlina je medzi 5.5 a 8.0 pH jednotiek, ale niektoré baktérie a huby majú viac alkalických enzýmov a viac kyslých.
Môže vám slúžiť: fylogéniaEnzýmy prítomné v slinách a cicavčích pankrease fungujú lepšie pri pH blízko 7 (neutrálne) navyše, vyžadujú chloridové ióny na dosiahnutie maximálnej enzymatickej aktivity a sú schopní spojiť dvojmocné vápnikové ióny.
Obe zvieratá, slinné a pankreatické enzýmy sa vyrábajú v organizmoch nezávislými mechanizmami, ktoré zahŕňajú špecifické bunky a žľazy a ktoré pravdepodobne nesúvisia s enzýmami prítomnými v obehovom torrente a iných telesných dutinách.
PH aj optimálna teplota pre fungovanie týchto enzýmov veľmi závisí od fyziológie organizmu, ktorý sa uvažuje, pretože existujú extrémne mikroorganizmy, ktoré rastú vo veľmi konkrétnych podmienkach, pokiaľ ide o tieto a mnoho ďalších parametrov.
Nakoniec, pokiaľ ide o reguláciu jej aktivity, charakteristické zdieľané medzi enzýmami skupiny a-amyláz je, že tieto, rovnako ako iné amylázy, môžu byť inhibované iónmi ťažkých kovov, ako sú ortuť, meď, striebro a olovo.
Štruktúra
A-amyláza je multidomíniový enzým, ktorý u zvierat a rastlín má približnú molekulovú hmotnosť 50 kDa a rôzni autori súhlasia s tým, že enzýmy patriace tejto rodine glykohydrolesázy sú enzýmy s viac ako desiatimi štrukturálnymi doménami.
Centrálna doména alebo katalytická doména je veľmi konzervovaná a je známa ako doména A, ktorá pozostáva zo symetrického záhybu 8 β-plachovaných listov usporiadaných vo forme „valca“, ktorý je obklopený 8 hálmi alfa, takže môžete tiež nájsť V literatúre, ako (β/α) 8 alebo „tim“ typu hlavne.
Je dôležité poznamenať, že na C-terminálnom konci β listov domény A sú konzervovaný odpad aminokyseliny, ktorý sa podieľa na katalýze a na križovatke substrátu a že táto doména sa nachádza v N-terminálnej oblasti v N-terminálnej oblasti v N-terminálnej oblasti v N-terminálnej oblasti proteín.
Môže vám slúžiť: fauna a flóra peruánskeho moraĎalšou z najštudovanejších domén týchto enzýmov je tzv. To zohráva základnú úlohu v Únii substrátu a dvojmocného vápnika.
Boli opísané ďalšie domény pre enzýmy a-amylasy, ako sú domény C, D, F, H a I, ktoré sa nachádzajú vpredu alebo zadnú časť domény A a ktorých funkcie nie sú známe presne a závisia od organizmu, že organizmus, ktorý študuje sa.
a-amylázy mikroorganizmov
Závisí molekulová hmotnosť a-amylázy, ako aj ďalšie biochemické a štrukturálne charakteristiky od študovaného organizmu. Preto a-amylázy mnohých húb a baktérií majú váhy až 10 kDa a až 210 kDa.
Vysoká molekulová hmotnosť niektorých z týchto mikrobiálnych enzýmov často súvisí s prítomnosťou glykozilácie, hoci glykozylácia proteínu v baktériách je pomerne zriedkavá.
Funkcia
U zvierat sú a-amylázy zodpovedné za prvé kroky v metabolizme škrobu a glykogénu, pretože sú zodpovedné za ich hydrolýzu do menších fragmentov. Orgány gastrointestinálneho systému zodpovedný za ich výrobu u cicavcov sú pankreas a slinné žľazy.
Okrem svojej zjavnej metabolickej funkcie, výrobu a-amyláz produkovaných slinnými žľazami mnohých cicavcov, aktivovaných norepinefrínom pôsobením, mnohí autori považujú za dôležitý „psychobiologický“ stresový marker v strese v centrálnom nervovom systéme.
Má tiež sekundárne funkcie v orálnom zdraví, pretože jej aktivita funguje pri odstraňovaní perorálnych baktérií a pri prevencii jej adhézie na ústne povrchy.
Môže vám slúžiť: Sympatrická špekulácia: Koncept, charakteristiky a príkladyHlavná funkcia v rastlinách
V rastlinách hrajú a-amylázy primárnu úlohu pri klíčení semien, pretože sú to enzýmy, ktoré hydrolyzujú škrob prítomný v endosperme, ktorý vyživuje embryo vo vnútri, proces v podstate kontrolovaným gibberelínom, fytormónom.
Priemyselné aplikácie
Enzýmy patriace do rodiny a-amyláz majú viacnásobné aplikácie v mnohých rôznych kontextoch: priemyselné, vedecké a biotechnologické atď.
Vo veľkých odvetviach spracovania škrobu sa a-amylázy používajú na výrobu glukózy a fruktózy, ako aj na výrobu chleba so zlepšenými textúrami a s väčšou lojálnou kapacitou.
V biotechnologickej oblasti existuje veľký záujem o zlepšenie komerčne používaných enzýmov, aby sa zlepšila ich stabilita a výkon v rôznych podmienkach.
Odkazy
- Aiyer, P. Vložka. (2005). Amylázy a ich aplikácie. Africký denník biotechnológie, 4(13), 1525-1529.
- Bernfeld, P. (1960). Amylázy, A a B. V Enzýmy metabolizmu uhľohydrátov (Zv. I, pp. 149-158).
- Granger, D. Do., Kivighan, K. Tón., M., Gordis, e. B., & Stud, L. R. (2007). Slinné a-a-a-a-a-and v biobehaviorálnom výskume. Posledný vývoj a aplikácie. Postihnúť. N.A. Šupka. Sci., 1098, 122-144.
- Monteiro, P., & Oliveira, P. (2010). Aplikácia mikrobiálnej A-a-a-a-a-andlas v priemysle- preskúmanie. Brazílsky denník mikrobiológie, 41, 850-861.
- Reddy, n. Siež., Nimmagadda, a., & Rao, K. R. Siež. Siež. (2003). Prehľad mikrobiálnej rodiny a-láska. Africký denník biotechnológie, 2(12), 645-648.
- Soľ, w., & Shenker, s. (1976). Amyláza- jej klinický význam: prehľad literatúry. Liek, 55(4), 269-289.
- Svensson, B., & MacGregor a. Do. (2001). Vzťah sekvencie a štruktúry k špecifickosti v rodine enzýmov A-amylázy. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. Do., Spradlin, J. A., & Dygert, s. (1925). Amylázy rastlín a zvierat. Postihnúť. Chem., 1, 115-189.
- « Štruktúra renínu, výroba, sekrécia, funkcie
- Urie Bronfenbrenner Biografia, ekologický model a príspevky »

