Terciárna štruktúra alkoholu, vlastnosti, príklady
- 2522
- 702
- MUDr. Žigmund Boška
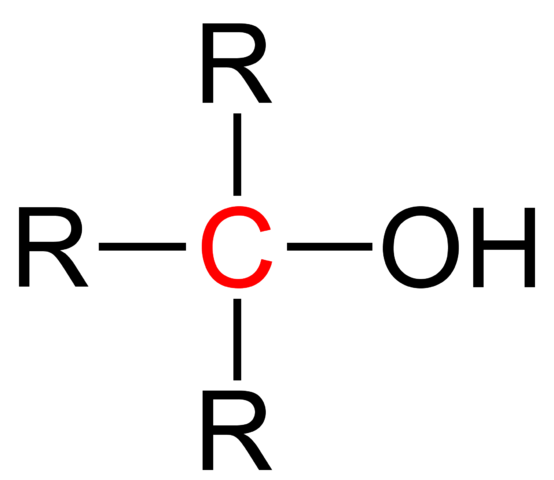
A Terciárny alkohol Je to jedna, v ktorej je hydroxylová skupina, OH, spojená s terciárnym uhlíkom. Jeho vzorec je naďalej ROH, rovnako ako iné alkoholy; Ale je ľahko rozpoznávaný, pretože OH je blízko x v molekulárnej štruktúre. Jeho sýtený reťazec je tiež zvyčajne kratší a jeho hlavná molekulárna hmota.
Potom má terciárny alkohol tendenciu byť ťažší, je viac rozvetvený a je tiež najmenej reaktívnym vzhľadom na oxidáciu; to znamená, že sa nemôže transformovať na cetón alebo karboxylovú kyselinu, ako sa vyskytuje pri sekundárnych a primárnych alkoholoch.
 Štrukturálny vzorec terciárneho alkoholu. Zdroj: Jü [verejná doména].
Štrukturálny vzorec terciárneho alkoholu. Zdroj: Jü [verejná doména]. Všeobecný štrukturálny vzorec pre terciárny alkohol je znázornený na hornom obrázku. Podľa nej bolo možné napísať nový vzorec typu r3COH, kde r môže byť alkyl alebo aryl; Skupina Methilo, CH3, alebo krátky alebo dlhý sýtený reťazec.
Ak sú tri skupiny R, ústredný uhlík terciárneho alkoholu bude chirálny; to znamená, že alkohol bude predstavovať optickú aktivitu. Z tohto dôvodu sú terciárne kvirálne alkoholy účtované úrokom vo farmaceutickom priemysle, pretože z ketónov s biologickou aktivitou sú tieto alkoholy syntetizované s komplexnejšími štruktúrami.
[TOC]
Štruktúra terciárneho alkoholu
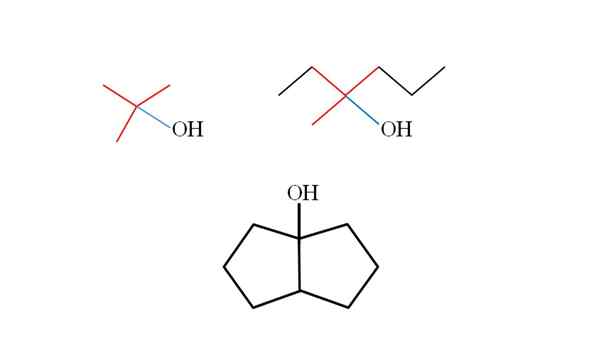 Tri terciárne alkoholy a ich štruktúry. Zdroj: Gabriel Bolívar.
Tri terciárne alkoholy a ich štruktúry. Zdroj: Gabriel Bolívar. Zvážte štruktúry horných terciárnych alkoholov, aby ste ich naučili rozpoznávať bez ohľadu na zlúčeninu. Uhlík spojený s OH musí byť tiež spojený s tromi ďalšími uhlíkmi. Ak sa podrobne pozoruje, tieto tri alkoholy sú v súlade s týmto.
Prvý alkohol (vľavo) pozostáva z troch skupín ch3 Centrálny uhlík spojený, ktorého vzorec by bol (Cho3)3CoH. Skupina prenájmu (vyberte si3)3C- je známy ako tertbutil.
Môže vám slúžiť: Potentiometer (fameter)Druhý alkohol (napravo) má centrálny uhlíkový lin3, Chvály3Chvály2 a Ch2Chvály2Chvály3. Pretože tieto tri skupiny sú rôzne, alkohol je chirálny, a preto vykazuje optickú aktivitu. Tu sa tu nepozoruje, ale X blízko OH (červená a modrá).
A v treťom alkoholu (nižšie a bez farieb) je OH spojená s jedným z dvoch uhlíkov, ktoré sa spájajú s dvoma cyklopentano. Tento alkohol nepredstavuje optickú aktivitu, pretože dve z centrálnych skupín spojených s uhlíkom sú identické. Rovnako ako druhý alkohol, ak je pozorne pozorovaný, nájde sa aj X (skôr tetrahedron).
Stérická prekážka
Tri vynikajúce alkoholy majú niečo viac spoločné ako X: Centrálne uhlík sa bráni stericky; to znamená, že vo vesmíre je veľa atómov. Okamžitým dôsledkom toho je, že nukleofily, ktoré túžia po pozitívnych nábojoch, majú problémy s priblížením sa k tomuto uhlíku.
Na druhej strane, s tromi uhlíkom spojenými s centrálnym uhlíkom, darujú časť elektronickej hustoty, že ho odčíta elektronegatívny atóm kyslíka a ešte viac ho stabilizuje pred týmito nukleofilnými útokmi. Terciárny alkohol však môže utrpieť substitúciu vytvorením karbocation.
Vlastnosti
Fyzický
3. alkoholy vo všeobecnosti vykazujú vysoko rozvetvené štruktúry. Prvým dôsledkom toho je, že sa zabráni skupine OH, a preto jej dipólový moment má menší účinok na susedné molekuly.
To sa premieta do slabších molekulárnych interakcií v porovnaní s primárnymi a sekundárnymi alkoholmi.
Môže vám slúžiť: Le Châtelier princípZvážte napríklad štrukturálne izoméry butanolu:
Chvály3Chvály2Chvály2Oh (n-Butanol, Peb = 117 ° C)
(Ch3)2Chvály2OH (izobutilický alkohol, PEB = 107 ° C)
Chvály3Chvály2Ch (oh) ch3 (Secbutilic alkohol, PEB = 98 ° C)
(Ch3)3COH (Tertbutilic alkohol, PEB = 82 ° C)
Všimnite si, ako body varu zostupujú, keď sa izomér stáva viac rozvetveným.
Spočiatku sa uvádza, že v štruktúrach alkoholov 3 a x sa pozoruje, čo samo osebe naznačuje vysokú vetvu. Preto tieto alkoholy majú tendenciu mať nižšie body topenia a/alebo varu.
Mierne podobný je prípad vašej miešateľnosti s vodou. Čím viac zabránili, tým menej miešateľný OH bude alkohol 3 s vodou. Táto miešateľnosť však klesá, čím dlhší je uhlíkový reťazec; Tepelný alkohol je teda rozpustnejší a miešateľný s vodou ako n-Butanol.
Kyslosť
Terciárne alkoholy majú tendenciu byť najmenej kyseliny zo všetkých. Dôvody sú početné a navzájom sa vzťahujú. V súhrne účty negatívne zaťaženie odvodeného alcoxidu, červené-, Budete cítiť silné odpudenie pre tri alkal skupiny spojené s centrálnym uhlíkom, čo oslabuje anión.
Čím nestabilnejší anión, tým menej bude kyslosť alkoholu.
Reaktivita
3. alkoholy nemôžu utrpieť oxidácie ketónom (r2C = o) alebo aldehydos (rcho) alebo karboxylové kyseliny (RCOOH). Na jednej strane by som musel stratiť jeden alebo dva uhlíky (vo forme CO2) oxidovať, čo znižuje jeho reaktivitu proti oxidácii; A na druhej strane chýba vodík, ktorý môže stratiť, aby vytvoril ďalšie spojenie s kyslíkom.
Môže vám slúžiť: pyridín: štruktúra, vlastnosti, použitie, toxicita, syntézaMôžu však trpieť substitúciou a elimináciou (tvorba dvojitého väzby, alkénu alebo olefínu).
Menovanie
Nomenklatúra pre tieto alkoholy sa nelíši od inej. Existujú bežné alebo tradičné názvy a systematické mená riadené IUPAC.
Ak hlavný reťazec a jeho dôsledky pozostávajú z uznávanej skupiny prenájmu, používa sa pre svoj tradičný názov; Ak to nie je možné, používa sa nomenklatúra IUPAC.
Zvážte napríklad nasledujúci terciárny alkohol:
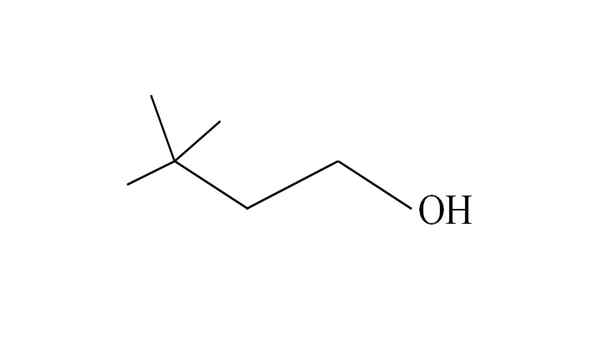 3,3-dimetyl-1-butanol. Zdroj: Gabriel Bolívar.
3,3-dimetyl-1-butanol. Zdroj: Gabriel Bolívar. Začína vymenovať uhlíky sprava doľava. V C-3 sú dve skupiny ch3 substituentov, a preto názov tohto alkoholu je 3,3-dimetyl-1-butanol (hlavný reťazec má štyri uhlíky).
Podobne celý reťazec a jej dôsledky pozostávajú zo skupiny Neohexilo; Preto jeho tradičným názvom môže byť neohexylalkohol alebo neohexanol.
Príklady
Nakoniec sú uvedené niektoré príklady terciárnych alkoholov:
-2-metyl-2-propanol
-3-metyl-3-hexanol
-Biciclo [3,3,0] Octan-1-ol
-2-metyl-2-butanol: Ch3Chvály2Coh (ch3)2
Vzorce prvých troch alkoholov sú zastúpené na prvom obrázku.
Odkazy
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. (5. vydanie). Redakčný Addison-Wesley Inter-American.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- Gunawardena Gamini. (31. januára 2016). Terciárny alkohol. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Ashenhurst James. (16. júna 2010). Alkoholy (1) - nomenklatúra a vlastnosti. Získané z: Masterorganicchemistry.com
- Clark J. (2015). Predstavujeme alkoholy. Získané z: Chemguide.co.Uk
- Organická chémia. (s.F.). Téma 3. Alkoholy. [PDF]. Získané z: Sinorg.Uji.je
- Nilanjana Majumdar. (3. marca 2019). Syntéza chirálneho terciárneho alkoholu: významný vývoj. Získané z: 2.Chémia.MSU.Edu
- « Formatívne obdobie amerického pôvodu, charakteristiky, výrobky
- Aká bola európska spoločnosť v prvej polovici devätnásteho storočia »

