Sekundárny alkohol, čo je, štruktúra, vlastnosti, použitia
- 3211
- 605
- Mgr. Pravoslav Mokroš
Čo je to sekundárny alkohol?
A druhoradý alkohol Má uhlíkový uhlík hydroxylovej skupiny (OH), pripojený k dvom uhlíkom. Medzitým je v primárnom alkoholu uhlík uhlíka hydroxylovej skupiny spojený s atómom uhlíka a v terciárnom alkoholu pripojenom k trom atómom uhlíka.
Alkoholy sú mierne slabšie kyseliny ako voda, s nasledujúcou PKA: voda (15,7); Metylalkohol (15,2), etyl (16), izopropyl (sekundárny alkohol, 17) a tepelný (18). Ako je zrejmé, izopropylalkohol je menej kyslý ako metyl a etylalkoholy.
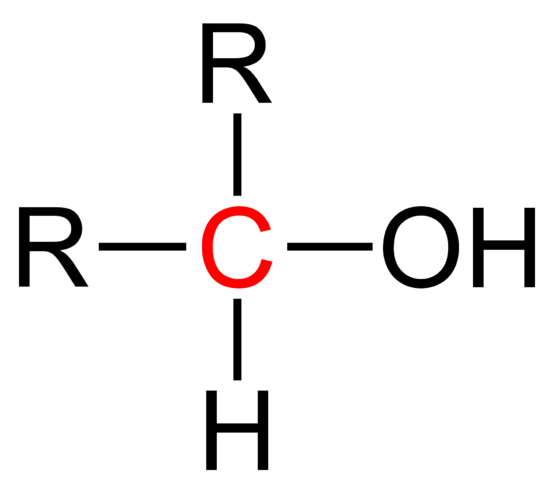
 Štrukturálny vzorec sekundárneho alkoholu. Wikimedia Commons
Štrukturálny vzorec sekundárneho alkoholu. Wikimedia Commons Na hornom obrázku je zobrazený štrukturálny vzorec pre sekundárny alkohol. Červený uhlík je nositeľom OH a je spojený s dvoma alkyl (alebo aryl) r skupinami a jediným atómom vodíka.
Všetky alkoholy majú generický vzorec ROH; Ale ak je uhlík na nosiče podrobne pozorovaný, potom sa získajú primárne alkoholy (RCH2Oh), sekundárne (r2Choh, vychovaný tu) a terciárny (r3Coh). Táto skutočnosť robí rozdiel vo svojich fyzických vlastnostiach a reaktivite.
Štruktúra sekundárneho alkoholu
Alkoholové štruktúry závisia od povahy skupín R. Avšak pre sekundárne alkoholy je možné vykonať určité príklady, vzhľadom na to, že môžu existovať iba lineárne štruktúry s alebo bez dôsledkov alebo cyklických štruktúr. Napríklad máte nasledujúci obrázok:
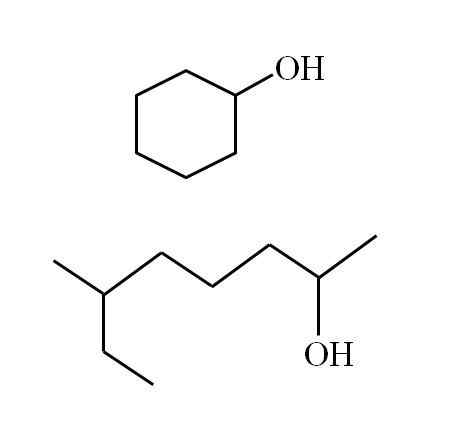 Cyklický sekundárny alkohol a ďalší rozvetvený reťazec. Zdroj: Gabriel Bolívar
Cyklický sekundárny alkohol a ďalší rozvetvený reťazec. Zdroj: Gabriel Bolívar Všimnite si, že pre obe štruktúry je niečo spoločné: OH je spojené s „v“. Každý koniec V predstavuje rovnakú skupinu (horná časť obrázka, cyklická štruktúra) alebo iná (dolná časť, rozvetvený reťazec).
Týmto spôsobom je akýkoľvek sekundárny alkohol veľmi ľahko identifikovaný, aj keď jeho nomenklatúra nie je vôbec známa.
Vlastnosti
Body varu
Vlastnosti sekundárnych alkoholov sa príliš nelíšia od iných alkoholov. Zvyčajne sú to priehľadné kvapaliny a aby boli pevnou látkou pri teplote miestnosti, musí tvoriť niekoľko vodíkových mostov a mať vysokú molekulárnu hmotnosť.
Môže vám slúžiť: Kyselina perbromová (HBRO4): Vlastnosti, riziká a použitiaAvšak rovnaký štrukturálny vzorec r2CHOH navrhuje pre tieto alkoholy vo všeobecnosti určité jedinečné vlastnosti. Napríklad skupina OH je menej exponovaná a dostupná pre interakcie vodíkových mostov, r2Ch-oh-ohchr2.
Je to preto, že skupiny R, susediace s uhlíkom automobilu, môžu byť prinesené a prekážajú tvorbe vodíkových mostov. Výsledkom je, že sekundárne alkoholy majú nižšie body varu ako primárne (RCH2Oh).
Kyslosť
Podľa definície Brönsted-Lowry je kyselina, ktorá daruje protóny alebo vodíkové ióny, h+. Keď sa to stane so sekundárnym alkoholom, máte:
R2CHOH + B- => R2Choď- + HB
Konjugát Ras2Choď-, Alcoxid Anion, vaše záporné zaťaženie sa musí stabilizovať. V prípade sekundárneho alkoholu je stabilizácia nižšia, pretože dve skupiny R majú elektronickú hustotu, ktorá do určitej miery odpudzuje negatívne zaťaženie atómu kyslíka.
Medzitým pre alkoxidový anión primárneho alkoholu, RCH2Ani-, Existuje menej elektronického odporu, ktorý má iba jednu skupinu R a nie dve. Okrem toho atómy vodíka nevykonávajú významné odpudenie a naopak prispievajú k stabilizácii negatívneho zaťaženia.
Preto sú sekundárne alkoholy menej kyslé ako primárne alkoholy. Ak je to tak, potom sú základné a presne z rovnakých dôvodov:
R2Choh + h2B+ => R2Hanba2+ + HB
Teraz skupiny R stabilizujú pozitívne zaťaženie kyslíka tým, že poskytujú časť svojej elektronickej hustoty.
Reakcie
Vodíkový halgenid a fosfor trihalogenid
Sekundárny alkohol môže reagovať s halogenidom vodíka. Chemická rovnica reakcie medzi izopropylalkoholom a kyselinou bromyterovou je znázornená v prostriedku kyseliny sírovej a produkuje izopropyl bromid:
Chvály3Škriatok3 + Hbr => ch3Chmrch3 + H2Ani
A môžete tiež reagovať s trihagenuerom fosforu, px3 (X = br, i):
Môže vám slúžiť: hydroxid niklu (III): Štruktúra, vlastnosti, použitia, rizikáChvály3-Chech-ch2-Chvály2-Chvály3 + PBR3 => CH3-CHBR-CH2-Chvály2-Chvály3 + H3Po3
Chemikália vyššie zodpovedá reakcii medzi rezom a tribromidom fosforu, čo spôsobuje bromid SEC-pentil.
Všimnite si, že v obidvoch reakciách je sekundárny alkyl halogenid (R2Chx).
Dehydratácia
V tejto reakcii sa stratia H a OH susedných uhlíkov, čím sa vytvorí dvojitá väzba medzi týmito dvoma atómami uhlíka. Preto existuje tvorba alkénu. Reakcia vyžaduje kyslý katalyzátor a prívod tepla.
Alkohol => alkén + h2Ani
Máte napríklad nasledujúcu reakciu:
Cyklohexanol => cyklohexen + h2Ani
Reakcia s aktívnymi kovmi
Sekundárne alkoholy môžu reagovať s kovmi:
Chvály3-Chech-ch3 + K => Cho3Choď-Klimatizovať+Chvály3 + ½ h+
Tu izopropylalkohol reaguje s draslíkom za vzniku izoproxidu draselného a vodíkových iónov.
Esterifikácia
Sekundárny alkohol reaguje s kyselinou karboxylovou, aby vznikol ester. Napríklad chemická rovnica reakcie sekutilného alkoholu je znázornená s kyselinou octovou, ktorá produkuje semi-butylacetát:
Chvály3Škriatok2Chvály3 + Chvály3Cooh CH3Kolo3Chvály2Chvály3
Oxidácia
Primárne alkoholy oxidujú aldehydos a tieto zase oxidujú karboxylové kyseliny. Ale sekundárne alkoholy oxidujú acetón. Reakcie sa zvyčajne katalyzujú draselnými dichromát (K2Croch7) a kyselina chromová (h2Croch4).
Globálna reakcia je:
R2Choh => r2C = O
Menovanie
Sekundárne alkoholy sú menované ukazovaním na polohu skupiny OH v hlavnom reťazci (dlhšie). Toto číslo predchádza názvu alebo môže ísť za názvom príslušnej alkáne pre uvedený reťazec.
Napríklad Cho3Chvály2Chvály2Chvály2Škriatok3, Je to 2-hexanol alebo hexan-2-do.
Ak je štruktúra cyklická, nie je potrebné umiestniť čitateľa; Pokiaľ neexistujú iné substituenty. Preto sa cyklický alkohol druhého obrázka nazýva cyklohexanol (prsteň je hexagonálny).
Môže vám slúžiť: amínyA pre druhý alkohol toho istého obrazu (rozvetvený), jeho názov je: 6-etyl-heptan-2 -ol -ol.
Žiadosti
-Sec-butanol sa používa ako rozpúšťadlo a stredná chemikália. Je prítomný v hydraulických tekutinách pre brzdy, priemyselné čistiace prostriedky, leštenie, pinting, flotačné činidlá a ovocie a parfumy esencie.
-Izopropanolový alkohol sa používa ako priemyselné rozpúšťadlo a ako antikoagulant. Používa sa v olejoch a atramentoch s rýchlym sušením, ako je antiseptický a náhradný kozmetický etanol (napríklad: kožné pleťové vody, kapilárne tonikum a alkohol trecieho).
-Izopropanol je zložka tekutých mydiel, čistiacich prostriedkov na kryštály, syntetické aromatizátory nealkoholických nápojov a potravín. Okrem toho je to stredná chemikália.
-Cyklohexanol sa používa ako rozpúšťadlo, v tkanivovej povrchu, pri spracovaní kože a emulgácie mydiel a syntetických detergentov.
-Metylciclohexanol je zložka žuvacích výrobkov založených na mydle a detergentoch pre špeciálne tkanivá.
Príklady
2-oktaol
 Molekula 2-ortanola. Zdroj: Jü [verejná doména], z Wikimedia Commons
Molekula 2-ortanola. Zdroj: Jü [verejná doména], z Wikimedia Commons Je to mastný alkohol. Je to bezfarebná tekutina, málo rozpustná vo vode, ale rozpustná vo väčšine nepolárnych rozpúšťadiel. Používa sa okrem iného v rozpracovaní príchutí a vôní, maľieb a povlakov, atramentov, lepidiel, starostlivosti o domácnosť a mazivá.
Estradiol alebo 17p-quadiol
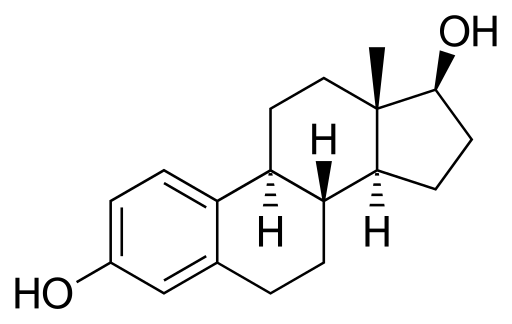 Molekula estradiolu. Zdroj: Neurotoger [verejná doména], z Wikimedia Commons
Molekula estradiolu. Zdroj: Neurotoger [verejná doména], z Wikimedia Commons Je to steroidný sexuálny hormón. Má vo svojej štruktúre dve skupiny Hydroxilli. Je to prevládajúci estrogén počas reprodukčných rokov.
20-hydroxy-leukotrién
Je to metabolit, ktorý pravdepodobne pochádza z oxidácie leukotriénového lipidu. Je klasifikovaný ako leukotrién cystinyl. Tieto zlúčeniny sú mediátormi zápalového procesu, ktoré prispievajú k patofyziologickým charakteristikám alergickej rinitídy.
2-heptanol
Je to alkohol, ktorý sa nachádza v ovocí. Okrem toho sa nachádza v zázvorovom oleji a jahode. Je priehľadný, bezfarebný a nerozpustný vo vode. Používa sa ako rozpúšťadlo niekoľkých živíc a zasahuje do flotačnej fázy pri spracovaní minerálov.
Odkazy
- Encyklopédia zdravia a bezpečnosti v práci. (s.F.). Alkoholy. [PDF]. Obnovené z: Insht.je
- Štruktúra a klasifikácia alkoholov. Chémia librettexts. Získané z: Chem.Librettexts.orgán

