Primárna štruktúra alkoholu, vlastnosti, nomenklatúra, príklady

- 731
- 184
- Tomáš Klapka
A primárny alkohol Je to jeden, v ktorom je hydroxylová skupina spojená s primárnym uhlíkom; To znamená, že kovalentne pripojený uhlík k inému uhlíkovi a hydrogénom. Jeho všeobecný vzorec je ROH, konkrétne RCH2Och, pretože existuje iba jedna prenájom skupiny r.
RCH Formula R Group R2Och, môže to byť ktokoľvek: reťaz, prsteň alebo heteroatómy. Pokiaľ ide o reťaz, krátku alebo dlhú, je to pred najreprezentatívnejším primárnym alkoholom; Medzi nimi patrí metanol a etanol, dva z najviac syntetizovaných na priemyselnej úrovni.
 Pivo: príklad vodného roztoku etylalkoholu, primárneho alkoholu, v organickej matrici. Zdroj: Engin Akyurt cez pexels.
Pivo: príklad vodného roztoku etylalkoholu, primárneho alkoholu, v organickej matrici. Zdroj: Engin Akyurt cez pexels. Fyzicky sú ako iné alkoholy a ich body varu alebo fúzie závisia od stupňa ich dôsledkov; Ale chemicky sú najreaktívnejšie. Okrem toho je jej kyslosť lepšia ako v prípade sekundárnych a terciárnych alkoholov.
Primárne alkoholy zažívajú oxidačné reakcie a stávajú sa širokým počtom organických zlúčenín: estery a étery, aldehydy a karboxylové kyseliny. Môžu tiež trpieť dehydratačnými reakciami, stať sa alkénmi alebo olefínmi.
[TOC]
Štruktúra primárneho alkoholu
Primárne alkoholy odvodené z lineárnych alkánov sú najreprezentatívnejšie. V skutočnosti však môže byť v rámci tohto typu alkoholov klasifikovaná akákoľvek štruktúra, či už lineárna alebo rozvetvená2.
Takže, štrukturálne každý má spoločnú prítomnosť skupiny -ch2Och, nazývaný metylol. Charakteristikou a dôsledkom tejto skutočnosti je, že skupine OH je menej zabránená; to znamená, že môže interagovať s prostredím bez toho, aby iné atómy bránilo priestorovo.
Tiež menej zabránený OH znamená, že atóm uhlíka, ktorý ho nesie, si vyberte2, môže utrpieť náhradné reakcie pomocou SN mechanizmu2 (bimolekulárne, bez tvorby karbokácie).
Na druhej strane, OH s väčšou voľnosťou interakcie s prostredím, sa prekladá ako silnejšie intermolekulárne interakcie (vodíkovými mostmi), čo zase zvyšuje body fúzie alebo varu.
Môže vám slúžiť: hydroxid niklu (III): Štruktúra, vlastnosti, použitia, rizikáStáva sa to tiež s rozpustnosťou v polárnych rozpúšťadlách, pokiaľ skupina R nie je príliš hydrofóbna.
Vlastnosti
Kyslosť
Primárne alkoholy sú zo všetkých najkrajších. Aby sa alkohol správal ako kyselina Brnsted, musí darovať ión H+ do stredu, povedzme vodu, stať sa aniónom alcoxidu:
Roh + h2Zlato- + H3Ani+
Záporné zaťaženie červenej-, konkrétne z RCH2Ani-, Cítite menej odpudenia zo strany elektrónov dvoch väzieb C-H, ako elektrónmi väzby C-R.
Skupina prenájmu potom uplatňuje najväčší odpor a destabilizuje RCH2Ani-; ale nie toľko v porovnaní so skutočnosťou, že ak existujú dve alebo tri skupiny R, ako je to v prípade sekundárnych a terciárnych alkoholov.
Ďalším spôsobom, ako vysvetliť najväčšiu kyslosť primárneho alkoholu, je rozdiel v elektronegativite, ktorý vytvára dipólový moment: H2CΔ+-AniΔ-H. Kyslík priťahuje elektronickú hustotu obidve ch2 ako H; Pozitívne čiastočné zaťaženie uhlíka odpudzuje trochu vodíka.
Skupina R prenáša trochu svojej elektronickej hustoty Cho2, čo pomáha znižovať jeho pozitívne čiastočné zaťaženie as ňou jeho odpor po zaťažení vodíka. Čím viac skupín RA, tým nižšie je odpor, a preto trend H, ktorý sa má uvoľniť ako H+.
Pka
Primárne alkoholy sa považujú za najslabšie kyseliny ako voda, s výnimkou metylalkoholu, čo je o niečo silnejšie. PKA metylalkoholu je 15,2; A PKA etylalkoholu je 16,0. Medzitým je voda PKA 15,7.
Voda, ktorá sa považuje za slabú kyselinu, napríklad alkoholy, sa však môže pripojiť k h+ Transformácia na hydrium ión, h3Ani+; to znamená, že sa správa ako základ.
Rovnakým spôsobom môžu primárne alkoholy zachytiť vodík; Najmä v niektorých reakciách, ktoré sú vlastné, napríklad pri ich transformácii na alkény alebo olefíny.
Chemické reakcie
Prenájom halogenúrov
Alkoholy reagujú s halogenidmi vodíka za vzniku alkyl halogédov. Reaktivita alkoholov pred vodíkovými halogenidmi zostupuje v nasledujúcom poradí:
Môže vám slúžiť: uhlíkTerciárny alkohol> sekundárny alkohol> Primárny alkohol
Roh +hx => rx +h2Ani
RX je primárny alkyl halogenid (vyberte si3CL, ch3Chvály2Br, atď.).
Ďalším spôsobom, ako pripraviť alkyl halogenuros, je reakcia chloridu tionilo, syntetického činidla, s primárnym alkoholom, ktorý sa stáva alkylchloridom. Tionilo chlorid (SOCL2) vyžaduje reagovanie na prítomnosť pyridínu.
Chvály3(Ch2)3Chvály2Oh +SOCL2 => Ch3(Ch2)3Chvály2CL +SO2 + Hcl
Táto reakcia zodpovedá halogenácii 1-penolu, aby sa stala 1-clloropentano v prítomnosti pyridínu.
Oxidácia primárnych alkoholov
Alkoholy môžu byť oxidované na aldehydy a karboxylové kyseliny, v závislosti od činidla. Pyridínium chlorochromát (PCC) oxiduje primárny alkohol na aldehyd, pričom ako rozpúšťadlo použije dichlórmetán (CH (CH2Cl2):
Chvály3(Ch2)5Chvály2OH => Cho3(Ch2)5CoH
Toto je oxidácia 1-heptanolu v 1-heptáne.
Medzitým draslík permanganát (kmno4) Najprv alkoholový alkohol a potom oxidovaný na aldehyd na kyselinu karboxylovú. Ak sa na oxidáciu alkoholov použije permanganista draslíka, treba sa vyhnúť rozbitiu spojenia medzi uhlíkmi 3 a 4.
Chvály3(Ch2)4Chvály2OH => Cho3(Ch2)4Kohútik
Toto je oxidácia 1-hexanolu na kyselinu hexánovú.
Týmto spôsobom je ťažké získať aldehyd, pretože ľahko oxiduje kyselinu karboxylovú. Podobná situácia sa pozoruje, keď sa kyselina chromová používa na oxidáciu alkoholov.
Formácia e éteres
Primárne alkoholy sa môžu stať étermi, keď sa zahrievajú v prítomnosti katalyzátora, zvyčajne kyseliny sírovej:
2 rch2OH => RCH2Okradnúť2R +h2Ani
Tvorba organických esares
Kondenzácia alkoholu a kyseliny karboxylovej, rybárska esterifikácia, katalyzovaná kyselinou, produkuje ester a vodu:
Môže vám slúžiť: Karbocation: Tvorba, charakteristiky, typy, stabilitaR'OH +rcoOH rCoor ' +h2Ani
Známa reakcia je reakcia etanolu s kyselinou octovou, ktorá poskytne etylacetát:
Chvály3Chvály2Oh +ch3Cooh CH3Kohútik2Chvály3 + H2Ani
Primárny alkohol je najcitlivejší na Fischer sterifikačné reakcie.
Dehydratácia
Pri vysokých teplotách a v kyslom médiu, zvyčajne kyseline sírovej, dehydráty alkénov spôsobujú alkény so stratou molekuly vody.
Chvály3Chvály2Oh => h2C = ch2 + H2Ani
Toto je dehydratačná reakcia etanolu na etylén. Vhodnejším všeobecným vzorecom pre tento typ reakcie, konkrétne pre primárny alkohol, by bol:
Ruch2OH => r = Cho2 (Čo sa tiež rovná RC = CH2)
Menovanie
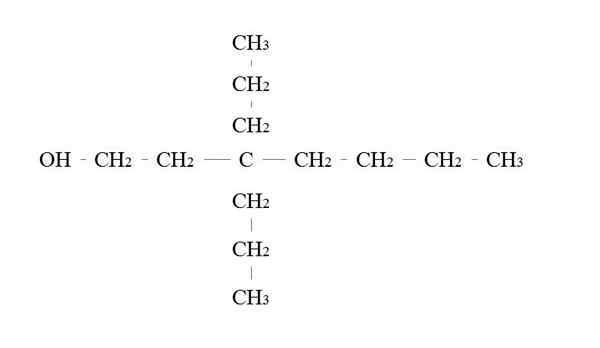 Príklad primárneho alkoholu. Zdroj: Gabriel Bolívar.
Príklad primárneho alkoholu. Zdroj: Gabriel Bolívar. Pravidlá na vymenovanie primárneho alkoholu sú rovnaké ako pre ostatné alkoholy; S výnimkou, že niekedy nie je potrebné vymenovať nosič OH.
Na hornom obrázku je hlavný sedem -karbonový reťazec. Uhlík spojený s OH je pridelený počet 1 a potom sa začína počítať zľava doprava. Jeho názov IUPAC je preto: 3,3 diatilheptanol.
Všimnite si, že toto je príklad vysoko rozvetveného primárneho alkoholu.
Príklady
Nakoniec sú niektoré primárne alkoholy uvedené podľa ich tradičnej a systematickej nomenklatúry:
-Metyl, ch3Oh
-Etyl, ch3Chvály2Oh
-N-propyl, ch3Chvály2Chvály2Oh
-N-hexyl, ch3Chvály2Chvály2Chvály2Chvály2Chvály2Oh
Sú odvodené od lineárnych alkánov. Ďalšie príklady sú:
-2-fenyletanol, C6H5Chvály2Chvály2Oh (c6H5 = benzénový prsteň)
-2-propen-1-OC (alilic alkohol), Cho2= Chch2Oh
-1,2-taodiol, ch2Ohromiť2Oh
-2-chlóroetanol (etyleclórhydrin), CLCH2Chvály2Oh
-2-buten-1-ol (crotililický alkohol), ch3Chch2Oh
Odkazy
- Morrison, r.Tón. A Boyd, r. N. (1987). Organická chémia. (5ubytovať sa Vydanie). Addison-Wesley Iberoamericana
- Carey, f. Do. (2008). Organická chémia. (6ubytovať sa Vydanie). McGraw-Hill, Intermerica, editor S.Do.
- Mel veda. (2019). Ako dochádza k oxidácii primárnych alkoholov. Získané z: Melscience.com
- Kráľovská spoločnosť chémie. (2019). Definícia: Primárne alkoholy. Získané z: RSC.orgán
- Chriss e. McDonald. (2000). Oxidácia primárnych alkoholov do esterov: tri súvisiace vyšetrovacie experimenty. J. Chem. Pedagóg., 2000, 77 (6), s. 750. Doi: 10.1021/ED077P750
- « Charakteristiky aktínu, štruktúra, vlákna, funkcia
- Diamagnetizmus materiály, aplikácie, príklady »

