Agent o redukcii koncepcie, najsilnejší príklady

- 4471
- 610
- Adrián Fajnor
A redukčné činidlo Je to látka, ktorá spĺňa funkciu redukcie oxidačného činidla pri oxidovej redukčnej reakcii. Redukčné činidlá sú donormi elektrónov od podstaty, zvyčajne látky, ktoré sú na ich najnižšej oxidačnej úrovni a s vysokým množstvom elektrónov.
Existuje chemická reakcia, pri ktorej sa oxidačné stavy atómov menia. Tieto reakcie zahŕňajú komplementárny redukčný a oxidačný proces. V týchto reakciách sa jeden alebo viac elektrónov jednej molekuly, atómu alebo iónu prenesie na inú molekulu, atóm alebo ión. To znamená, že produkcia reakcie na redukciu oxidu.

Počas procesu redukcie oxidu sa tento prvok alebo zlúčenina, ktorá stráca (alebo dona), jeho elektrón (alebo elektróny) nazýva redukčné činidlo, ktoré kontrastuje s oxidačným činidlom, ktorým je elektrónový receptor. Potom sa uvádza, že redukčné činidlá znižujú oxidačné činidlo a že oxidačné činidlo oxiduje redukčné činidlo.
Najlepšie alebo najsilnejšie redukčné činidlá sú tie, ktoré majú najväčšie atómové rádio; to znamená, že majú väčšiu vzdialenosť od svojho jadra k elektrónom, ktoré obklopujú rovnaké.
Redukčné látky sú zvyčajne kovové alebo negatívne ióny. Medzi bežné redukčné činidlá patrí kyselina askorbová, síra, vodík, železo, lítium, horčík, mangán, draslík, sodík, vitamín C, zinok a dokonca aj mrkva.
[TOC]
Čo znižujú agenti?
Ako už bolo povedané, redukčné činidlá sú zodpovedné za zníženie oxidačného činidla, keď dôjde k oxidovej redukčnej reakcii.
Jednoduchá a typická reakcia reakcie oxidu redukcie je reakcia aeróbneho bunkového dýchania:
Môže vám slúžiť: hydrid hliníka (ALH3): štruktúra, vlastnosti, použitiaC6H12Ani6(s) + 6o2g) → 6Co2g) + 6h2Alebo (l)
V tomto prípade, kde glukóza (c6H12Ani6) reaguje s kyslíkom (alebo2), glukóza sa správa ako redukčné činidlo, aby poskytla elektróny kyslíku - to znamená, že sa oxiduje - a kyslík sa stáva oxidačným činidlom.
V organickej chémii sa najlepšie redukčné činidlá považujú za reagenty, ktoré poskytujú vodík (H2) k reakcii. V tejto oblasti chémie sa redukčná reakcia týka pridania vodíka do molekuly, hoci predchádzajúca definícia (platí sa aj oxid-redukcia reakcií.
Faktory, ktoré určujú silu redukčného činidla
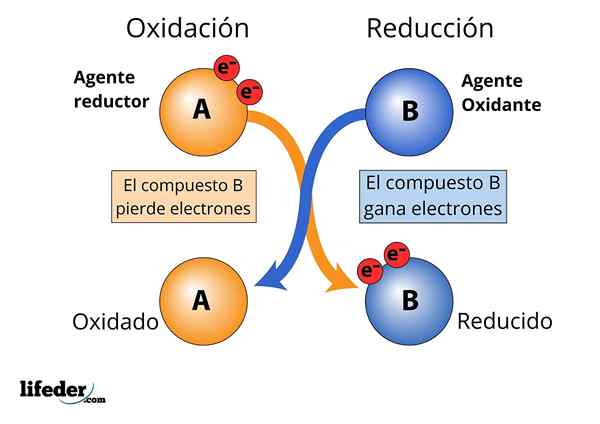 Oxidačné a redukčné činidlo, pozoruje sa strata a zisk elektrónov
Oxidačné a redukčné činidlo, pozoruje sa strata a zisk elektrónov Na to, aby sa látka považovala za „silnú“.
Z tohto dôvodu je potrebné vziať do úvahy množstvo faktorov, ktoré sa musia zohľadniť, aby sa rozpoznala sila, ktorú môže mať redukčné činidlo: elektronegativita, atómový polomer, ionizačná energia a potenciál redukcie.
Elektronegativita
Elektronegativita je vlastnosť, ktorá opisuje tendenciu atómu prilákania niekoľkých elektrónov zjednotených k sebe. Čím vyššia elektronegativita, tým väčšia je príťažlivosť, ktorú pôsobí atómom okolo okolitých elektrónov.
V periodickej tabuľke sa elektronegativita zvyšuje zľava doprava, takže alkalické kovy sú najmenej elektronegatívnymi prvkami.
Atómové rádio
Je to vlastnosť, ktorá meria množstvo atómov. Vzťahuje sa na typickú alebo priemernú vzdialenosť stredu atómového jadra na hranicu elektronického oblaku, ktorý ho obklopuje.
Môže vám slúžiť: Nitrites: Vlastnosti, štruktúra, nomenklatúra, formovanieTáto vlastnosť nie je presná - a okrem toho je do jej definície zapojených niekoľko elektromagnetických síl - je však známe, že táto hodnota klesá zľava doprava v periodickej tabuľke a zvyšuje sa zhora nadol. Preto sa alkalické kovy, najmä cézium, sa považujú za väčšie atómové rádio.
Ionizačná energia
Táto vlastnosť je definovaná ako energia potrebná na odstránenie menej zjednoteného elektrónu z atómu (elektrón Valencia) za vzniku katiónu.
Hovorí sa, že čím bližšie sú elektróny k jadru atómu, čím väčšia je ionizačná energia atómu.
Ionizačná energia sa zvyšuje zľava doprava a zdola nahor v periodickej tabuľke. Kovy (najmä alkalické) majú opäť menšiu ionizačnú energiu.
Potenciál
Je to miera tendencie chemického druhu získať elektróny, a preto sa znížiť. Každý druh má vnútorný potenciál redukcie: čím väčší je potenciál, tým väčšia je jeho afinita s elektrónmi a tiež jeho schopnosť redukovať.
Znižujúce sa látky sú tieto látky s menším redukčným potenciálom kvôli ich malej afinite s elektrónmi.
Silnejšie redukčné látky
Pri vyššie opísaných faktoroch je možné dospelé k záveru, že na nájdenie „silného“ redukčného činidla, atómu alebo molekuly s nízkou elektronegativitou, vysokým atómovým polomerom a nízkou ionizačnou energiou.
Ako už bolo spomenuté, tieto charakteristiky sú prítomné alkalické kovy a považujú sa za najsilnejšie redukčné látky.
Môže vám slúžiť: alifatické uhľovodíky: Vlastnosti, nomenklatúra, reakcie, typyNa druhej strane, lítium (Li) sa považuje za najsilnejšie redukčné činidlo za najnižší redukčný potenciál, zatiaľ čo molekula Liah4 Považuje sa za najsilnejšie redukčné činidlo zo všetkých, za to, že obsahuje toto a ďalšie požadované charakteristiky.
Príklady reakcií s redukčnými činidlami
V každodennom živote je veľa prípadov oxidu. Nižšie sú uvedené niektoré z najreprezentatívnejších:
Príklad 1
Spaľovacia reakcia oktánu (hlavná zložka benzínu):
2 c8H18(l) + 25o2 → 16Co2g) + 18h2O (g)
Môžete vidieť, ako oktán (redukčné činidlo) Dona kyslíkové elektróny (oxidačné činidlo), ktoré tvoria oxid uhličitý a vodu vo veľkých množstvách.
Príklad 2
Glukózová hydrolýza je ďalším užitočným príkladom bežnej redukcie:
C6H12Ani6 + 2ADP + 2P + 2NAD+ → 2ch3Kokos2H + 2atp + 2nadh
V tejto reakcii NAD molekuly (elektrónový receptor a oxidačné činidlo v tejto reakcii) berú glukózové elektróny (redukčné činidlo).
Príklad 3
Nakoniec v reakcii oxidu železitého
Vernosť2Ani3(s) + 2AL (s) → do2Ani3(s) + 2Fe (l)
Redukčné činidlo je hliník, zatiaľ čo oxidačným činidlom je železo.
Odkazy
- Wikipedia. (s.F.). Wikipedia. Získané z in.Wikipedia.orgán
- BBC. (s.F.). BBC.co.Uk. Získané z BBC.co.Uk
- Pearson, D. (s.F.). Chémia librettexts. Získané od Chem.Librettexts.orgán
- Výskum, b. (s.F.). Bodner Research Web. Získané od Murmeda.Chem.Purdue.Edu
- Peter Atkins, L. J. (2012). Chemické princípy: hľadanie vhľadu.
- « Cassia angustifolia vlastnosti, príprava, kontraindikácie
- Charakteristiky azimutálnej projekcie, typy, výhody, nevýhody »

