Dextrózové zemiaky, príprava a použitie
- 3900
- 363
- Václav Višňovský
On Dextróza zemiakový agar Je to solídne, neselektívne výživové kultivačné médium. V ňom môžu rásť bakteriálne a plesňové druhy, ale jeho použitie je indikované najmä na izoláciu vláknitých húb a kvasiniek. Je tiež známy ako médium PDA výrazom v anglickom agare dextrózy zemiakov.
Je to obzvlášť užitočné pre izoláciu fytopatogénnych húb, tj tie, ktoré ovplyvňujú zeleninu. Na zasievanie vzoriek z infikovanej zeleniny sa môžu použiť iné médiá, ako napríklad Sabouraud alebo sladový.
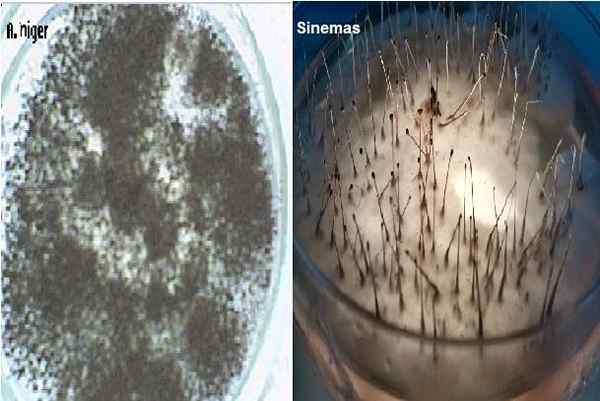
 Aspergillus Niger a Sinemas v dextróze pápežu agar. Zdroj: Alextrevelian 006 v angličtine Wikipedia [Public Domain]/Joselrojas [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Aspergillus Niger a Sinemas v dextróze pápežu agar. Zdroj: Alextrevelian 006 v angličtine Wikipedia [Public Domain]/Joselrojas [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Používa sa tiež na počítanie plesňových kolónií vo vzorkách kozmetiky, farmaceutických výrobkov a niektorých mliečnych potravín. Produkuje tiež pre siatie vzoriek škrabancov kože pri hľadaní dermatofytov, ktoré v tomto médiu rastú veľmi dobre a rozvíjajú ich charakteristické pigmenty.
Stredný dextróza pápež je veľmi jednoduché a ľahké médium v laboratóriu. Obsahuje, ako názov napovedá, infúzia zemiakov, dextróza a agar -agar. Okrem toho sa môžu pridať inhibičné látky, aby sa predišlo rastu baktérií a zvýšili selektivitu plesňových druhov.
[TOC]
Základ
Agar pápežu dextrózy je kultivačné médium, ktoré poskytuje potrebné výživové prvky na vývoj vláknitých húb a kvasiniek.
Kombinácia infúzie zemiakov glukózou poskytuje dokonalý zdroj energie, takže existuje uspokojivý rast húb. Zatiaľ čo Agar je ten, kto poskytuje konzistentnosť životnému prostrediu.
Samotné médium neinhibuje rast baktérií, preto je to neselektívne médium. Na to Selektívne potrebuje agregát inhibičných látok, ako je kyselina z tartarovej alebo antibiotiká.
Príprava
-Domáce (nekomercia) papa dextróza agar
Petriho taniere
Je pripravený nasledovne:
Po prvé, zemiaky sa veľmi dobre umývajú odstránením pôdy, ktorú majú. Sú rozrezané na jemné plátky so všetkým a škrupinou. 200 Gr zemiakov sa váži a varte v liter destilovanej vody, pol hodiny.
Čas je dokončený filtre alebo namáhajte celú prípravu gázou.
Získaná kvapalina je dokončená destilovanou vodou, až kým nedosiahne liter. Infúzia sa pridá 20 GR agar -agaru a 20 g gr dextrózy, dobre sa premieša a autoklava pri 121 ° C, 15 libier tlaku počas 15 minút.
Môže vám slúžiť: koevolúciaNechajte vychladnúť až 50 ° C a podávajte v petri sterilných platne. Pripravené dosky sa uchovávajú v chladničke.
Kliny
Môžete tiež pripraviť zemiakové kliny dextrózy.
V tomto prípade pred sterilizáciou v autokláve. Ušetrite v chladničke.
Médium je na pH 5.6 ± 0.2, niektoré laboratóriá však pridávajú 10% kyselinu z tartarovej na zníženie pH na 3,1 ± 0.1 s cieľom inhibovať bakteriálny rast.
V tom istom zmysle, iné laboratóriá uprednostňujú antibiotiká, aby tak robili selektívne pre kultiváciu húb a vyhýbali sa vývoju baktérií.
-Komerčná príprava dextrózy pápeža agar
Vážiť 39 g komerčne dostupnej dehydratovanej a rozpustenej v liter destilovanej vody. Odísť na 5 minút.
Zmes sa zahrieva často miešaním, až kým sa celkové rozpustenie. Následne sa sterilizuje v autokláve pri 121 ° C počas 15 minút.
Môžete pripraviť taniere alebo kliny. Postupujte podľa vyššie uvedeného.
PH je 5,6 ± 0,2. Ak je požadované pH 3,1, pred podávaním na doskách by sa malo pridať 14 ml kyseliny sterarovej zubovej k 20%.
Farba nepripraveného média je béžová a pripravená je čistá jantárová s mierne zamračeným alebo opalescentným vzhľadom.
Žiadosti
Proces pre výsadbu vzoriek rastlín v hrnci dextrózy
-Pre listy s škvrnami
Listy sú nakrájané na kúsky.
V plavidle 50 ccm s 50% alkoholom položte kúsky listov (zafarbené a zdravé kúsky), aby ste dezinfikovali povrch o 20 až 30 sekúnd. Hodiť alkohol a pridajte chlórnan sodný 20% počas 40 až 50 sekúnd, ak sú v poriadku, a zvýšte čas na 80 sekúnd, ak je kôra a kufre.
Vyhoďte chlórnan sodný a zoberte dezinfikované kúsky sterilnou svorkou a položte ich na stredný povrch (maximálne 10 kusov). Umiestnite dátum a inkubujte od 20 do 30 ° C.
-Pre ovocie a hľuzy
Ak je ovocie mäsité, otvorte ovocie postihnuté hubami a berte kúsky so sterilným skalpelom, tak chorá a zdravá časť a umiestnite ho na povrch agaru.
Ak je ovocie citrusové, napríklad citrón alebo pomaranč, jeho semená sa musia otvoriť a zasiať.
Môže vám slúžiť: fosfatidylinozitol: štruktúra, tréning, funkcieKeď je postihnutý ovocím a pozoruje sa výrežie, ideálnym je použitie nastrúhanej metódy na doske; Skladá sa z toho, že hranie so spórstvom so sterilizovanou a ochladenou špachtľou „L“ a potom vysiate do kľukat 2 až 3 krát na agare.
-Pre zrná
Dezinfikujú to isté, ako je opísané v listoch, a následne umiestnené na agar.
-Pre vetvy a stonky
Vykonáva sa malina kôry a potom sa odoberú kúsky zdravej a chorej časti a zasiahnuté priamo na agar.
Vysadené plaky sa inkubujú pri aerobióze pri 20-30 ° C počas 72 hodín.
Proces výsadby pokožky, vlasov alebo nechtov na agare pápežu dextrózy
Vzorka by sa mala vykonávať pomocou listu skalpel č. Pred odobratím vzorky musí byť plocha so 70% alkoholom dezinfikovaná.
-Kožná vzorka
V podvodných léziách musí byť hrana zranenia zoškrabaná, pretože je pravdepodobnejšie, že nájde huby.
V exsudačných léziách sa vzorka odoberie so suchým alebo mokrým tampónom. Sow okamžite nad pápežom dextrózou alebo agarom Sabouraud. Vyhýbajte sa dopravným prostriedkom.
Ďalšou metódou odobratia vzorky je technika Mariatu a kobercového námestia Ada Campos. V tomto prípade je postihnutá oblasť trieť 5 -krát kusom sterilnej vlny pre jej následnú plodinu.
Vzorka môže byť umiestnená priamo do kultivačného média.
-Vzorka vlasov
V závislosti od patológie je možné vystrihnúť postihnutú časť alebo koreňové štarty. Umiestnite vzorku do kultivačného média.
-Vzorka nechtu
Môžu sa zoškrabať alebo odrezať konkrétnu časť postihnutého nechtu. Bude závisieť od typu zranenia.
Predsiate vzorku na kúsky 1 mm pred zasiatím, aby sa zvýšila pravdepodobnosť kontaktu húb s kultúrnym médiom.
Identifikačný postup
Kolónie získané v doske sú izolované v skúmavkách obsahujú.
Mikroskopická štúdia (pozorovanie štruktúr a ich formácie) sa môže vykonať mikrokultúrami alebo priamym pozorovaním mikroskopu medzi hárkom a lamelami.
Môže vám slúžiť: histidín: Charakteristiky, štruktúra, funkcie, jedloKolónie počítať
Toto médium sa môže použiť aj na stanovenie záťaže húb a kvasiniek prítomných vo vzorkách rastlín, potravín, kozmetiky alebo liekov. Na tento účel sa používa agar doplnený zemiakom s antibiotikami, ako napríklad: (chloramfeniko, chlóretracyklín alebo oboje).
Nalejte 1 ml vzorky - najlepšie zriedené - na sterilnú a prázdnu Petriho tanier, potom roztavte zemiakovú pištoľ dextrózu a nechajte ju ochladiť pri 45 ° C. Nalejte cez Petriho tanier a otáčajte až do homogenizácie. Odísť v pokoji až do.
Inkubujte v aerobióze pri 20-25 ° C (formy) alebo pri 30-32 ° C (kvasinky) počas 5 až 7 dní alebo viac, v závislosti od typu hľadaného húb a od typu vzorky. Na inkubovanie oboch teplotných rozsahov sa môžu použiť dve platne.
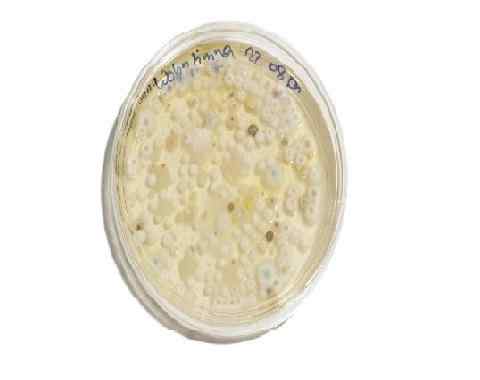 Profesor plesňových kolónií vo vzorke potravín. Dextróza zemiakový agar doplnený antibiotikami. Zdroj: pxhere.com photo/777267
Profesor plesňových kolónií vo vzorke potravín. Dextróza zemiakový agar doplnený antibiotikami. Zdroj: pxhere.com photo/777267 Údržba hubových kmeňov
Dextróza pápežu agar sa môže použiť na udržanie životaschopných kmeňov húb niekoľko rokov.
Z tohto. Olej musí byť sterilizovaný v autokláve 45 minút a má približnú viskozitu 300 až 330 Saybolt. Olej musí prekročiť 1 až 2 cm špičku rámu.
Qa
Z každej pripravenej šarže sa musí odobrať 1 alebo 2 doštičky a inkubovať sa pri 25 ° C počas 48 hodín alebo 20 ° C počas 96 hodín. Dobrá kontrola sterility je taká, v ktorej nie je pozorovaný vývoj kolónií.
Môžete tiež použiť známe alebo certifikované ovládacie prvky, napríklad:
Sacharomyces cerevisiae ATCC 9763, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Trichophyton mentagrofyty ATCC 9533. Vo všetkých prípadoch sa očakáva dobrý rast.
Odkazy
- Británske laboratóriá. Hrniec Glycosado. 2015. Dostupné na: BritánAlab.com
- Neogen laboratórium. Dextróza. K dispozícii na: Potravinová bezpečnosť.Neogén.com
- Laboratórium. Dextróza zemiakový agar. K dispozícii na: Insumolab.Cl
- Forbes B, Sahm D, Weissfeld a. (2009). Mikrobiologická diagnostika Bailey a Scott. 12 ed. PAN -AMERICKÁ REDICIAL S.Do. Argentína.
- Domáci dom G. Všeobecná mykológia. 1994. 2. vydanie. Venezuelská univerzita, vydania knižnice. Venezuela Caracas.
- Aceituno m. Vyhodnotenie mikrobiologickej kvality v očných tieňoch, kompaktný prach typu národného výrobného laboratória podľa Pharmacoea USP 2005. Diplomová práca, aby ste sa rozhodli pre názov farmaceutického chemika. University of San Carlos z Guatemaly.
- Cuétara m. Spracovanie povrchových vzoriek. Ibero -American Mycology Magazine. 2007; pp. 1-12

