Acrilonitrilova štruktúra, vlastnosti, výroba, použitie

- 3299
- 131
- Tomáš Klapka
On acrilonitril Je to organická zlúčenina, ktorej kondenzovaný vzorec je Cho2Chcn. Je to jeden z najjednoduchších nitrilov, ktoré existujú. Chémia a štrukturálne to nie je nič viac ako produkt spojenia medzi vinylovou skupinou, Cho2= CH- a NITRILE, KYANIDE GROUP, C≡N. Je to látka s veľkým priemyselným dopadom na svet plastov.
Fyzicky je to bezfarebná tekutina s určitou vôňou cibule a že v nečlenom stave predstavuje žltkasté tóny. Je vysoko horľavá, toxická a prípadne karcinogénna, takže je klasifikovaná ako mimoriadne nebezpečná látka. Je iróniou, že s ním sú vyrábané plasty a hračky každodenného života, ako sú Tupperware a LEGO bloky.
 Acrilonitril polyméry sú prítomné v plastickom plaste Tupperware. Zdroj: Stebulus cez Wikipedia.
Acrilonitril polyméry sú prítomné v plastickom plaste Tupperware. Zdroj: Stebulus cez Wikipedia. V priemyselných váhach, Acrilonitril. Takmer všetky vyrobené množstvo je určené na výrobu plastov založených na homopolyméroch, ako je polyakrylonitril alebo v kopolyméroch, ako je napríklad Acrilonitril-Butadién-styrén.
[TOC]
Acrilonitrilová štruktúra
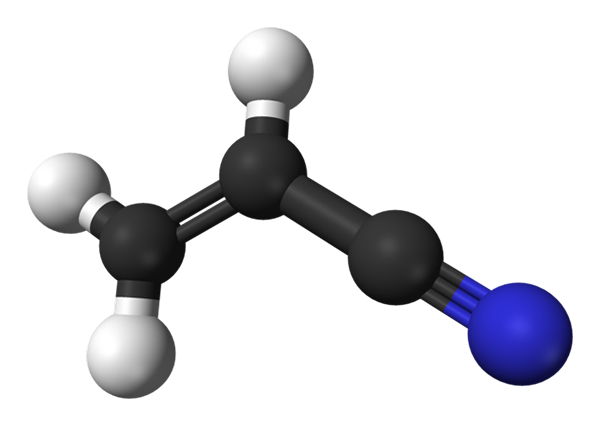 Molekulárna štruktúra acrilonitrilu. Zdroj: Benjah-Bmm27 / verejná doména
Molekulárna štruktúra acrilonitrilu. Zdroj: Benjah-Bmm27 / verejná doména Na hornom obrázku máme molekulu Acrilonitrile predstavovanú s modelom guľôčok a tyčí. Čierne gule zodpovedajú atómom uhlíka, zatiaľ čo biele a modré atómy vodíka a dusíka. Vľavo, ch2= CH- zodpovedá vinylovej skupine a práva skupine kyano, C≡n.
Celá molekula je plochá, pretože uhlíky vinylovej skupiny majú hybridizáciu SP2. Medzitým má skupina Ciano Group Carbon hybridizácia SP, ktorá je vedľa atómu dusíka v línii, ktorá spočíva na rovnakej rovine ako zvyšok molekuly.
Skupina CN prispieva polaritou k molekule, takže molekula cho Cho2CHCN stanovuje trvalý dipól, v ktorom je najvyššia elektronická hustota zameraná na atóm dusíka. Preto dipól-depol.
Môže vám slúžiť: Čo je chemická periodicita?Molekuly ch2CHCN sú ploché a sú schopní očakávať, že vo svojich kryštáloch (solidných pri -84 ° C) sú k dispozícii na sebe, ako sú napríklad listy papiera, aby sa ich dipóly neodrazili.
Vlastnosti
Fyzický vzhľad
Bezfarebná tekutina, ale so žltkastými tónmi, keď predstavuje určité nečistoty. Ak áno, odporúčajú ho pred jeho použitím destilovať. Je prchavý a má tiež intenzívnu vôňu podobnú cibule.
Molárna hmota
53 064 g/mol
Bod topenia
-84 ° C
Bod varu
77 ° C
Bod vzplanutia
-5 ° C (zatvorený šálka)
0 ° C (otvorený pohár)
Teplota
481 ° C
Hustota
0,81 g/cm3
Hustota
1,83 vo vzdušnom vzťahu.
Tlak vodnej pary
109 mmHg pri 25 ° C
Rozpustnosť
Vo vode má rozpustnosť 74 g/l až 25 ° C. Acrilonitril je tiež značne rozpustný v acetóne, oleji, etanole, etylacetáte a benzénovom etanilele.
Rozklad
Keď tepelne uvoľňuje toxický kyanid vodíka, oxidy uhlíka a oxidy dusíka.
Výroba
Sohio proces
Akryonitril sa môže vyskytnúť v masívnych mierkach prostredníctvom mnohých reakcií a chemických procesov. Zo všetkých z nich je proces Sohio najpoužívanejší, ktorý pozostáva z katalytickej amaxidácie propylénu. Vo fluidnom reaktore lôžka sa propylén zmieša s vzduchom a amoniakom pri teplote okolo 400 a 510 ° C, kde reagujú na tuhé katalyzátory.
Reaktanty vstupujú do reaktora raz a uskutočňujú sa nasledujúca reakcia:
2c3−ch = ch2 + 2 NH3 + 3 o2 → 2 ch2= CH-C≡N + 6 h2Ani
Všimnite si, že kyslík sa redukuje na vodu, zatiaľ čo propylén oxiduje Acrilonitril. Preto názov „amoxidácia“, pretože je to oxidácia, ktorá zahŕňa účasť amoniaku.
Môže vám slúžiť: varenie: Koncept, typy a príkladyAlternatívne procesy
Okrem procesu Sohio je možné spomenúť ďalšie reakcie, ktoré umožňujú získanie Acrilonitrilu. Je zrejmé, že nie všetky sú škálovateľné alebo prinajmenšom dostatočným ziskovým spôsobom, ani nevytvárajú výrobky s vysokou výkonnosťou alebo čistotou.
Akrylonitril je syntetizovaný opäť z propylénu, ale aby reagoval s oxidom dusnatého na katalyzátoroch PBO2-Zro2 letecký. Reakcia je nasledovná:
4 Ch3−ch = ch2 + 6 Nie → 4 Cho2= CH-C≡N + 6 h2Alebo + n2
Reakcia, ktorá nezahŕňa propylén, je reakcia, ktorá začína etylénexidom, ktorý reaguje s kyanidom vodíka na transformáciu do etylénového cyanohydrínu; A neskôr sa dehydruje pri teplote 200 ° C v Acrilonitrile:
ETO + HCN → CH2Ohromiť2CN
Chvály2Ohromiť2CN + Q (200 ° C) → CH2= CH-C≡N +H2Ani
Ďalšou oveľa priamejšou reakciou je pridanie kyanidu vodíka na acetylén:
HC≡CH + HCN → CH2= CH-C≡N
Vytvára sa však mnoho sekundárnych výrobkov, takže kvalita Acrilonitrilu je nižšia v porovnaní s kvalitou procesu Sohio.
Okrem vyššie uvedených látok, laktonitril, propionitril.
Žiadosti
 Legos sa vyrábajú hlavne s ABS Plastic, kopolymér, v ktorom je Acrilonitril súčasťou. Zdroj: pxhere.
Legos sa vyrábajú hlavne s ABS Plastic, kopolymér, v ktorom je Acrilonitril súčasťou. Zdroj: pxhere. Acrilonitril je nevyhnutnou látkou pre plastový priemysel. Niekoľko z jeho odvodených plastov je veľmi známy. Taký je prípad Acrilonitrilo-butadieén-styrénové kopolyméry (ABS), s ktorými sa vyrábajú kúsky laikov. Máme tiež akrylové vlákna, rozpracované homopolymérom polyakrylonitrilu (PAN).
Môže vám slúžiť: zubonifikáciaMedzi ďalšie plasty, ktoré obsahujú acrilonitril ako monomér alebo ktoré od neho závisia od jeho výroby, máme: akrylénové úsek (SAN), butadiénové akrylonitril (NBR), akrilonitrilový úsek akrylátu (ASA), polyakrylamid a syntetické rubbery a nitrilové resusy.
Prakticky môže byť akýkoľvek prírodný polymér, ako napríklad bavlna. Získajú sa teda deriváty nitrilu, čo robí chémiu veľmi širokého akrylonitrilu.
Jedným z jeho použití mimo sveta plastov je ako pesticíd zmiešaný s tetrachloridom uhlíka. Avšak kvôli svojmu hroznému vplyvu na morský ekosystém sa takéto pesticídy zakázali alebo sú predmetom silných obmedzení.
Riziká
Acrilonitril je nebezpečná látka, takže sa musí manipulovať s extrémnou starostlivosťou. Akékoľvek nevhodné alebo nadmerne predĺžené vystavenie tejto zlúčenine môže byť smrteľné, buď vdýchnutím, príjmom alebo fyzickým kontaktom.
Mal by sa udržiavať čo najďalej z akéhokoľvek zdroja tepla, pretože je to prchavá a veľmi horľavá kvapalina. Nemal by byť v kontakte s vodou, pretože s ňou násilne reaguje.
Okrem toho je to pravdepodobne karcinogénna látka, ktorá je spojená s rakovinou pečene a pľúc. Tí, ktorí boli vystavení tejto látke, majú zvýšenie hladín tiocyanátu vylučovaných v moči a krvný kyanid.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- Wikipedia. (2020). Akrylonitril. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2020). Akrylonitril. Databáza pubchem., CID = 7855. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Elsevier B.Vložka. (2020). Akrylonitril. Vedecký. Zdroj: ScienceDirect.com
- Korry Barnes. (2020). Čo je akrylonitril? - Používanie a vlastnosti. Štúdium. Získané z: štúdie.com
- Pyžonk, g.M., Manzalji, T. (1993). Syntéza akrylonitrilu z propylénových a zmesí oxidu dusnatého na PBO2-Zro2 Katalyzátory. Katal dvadsaťjeden, 361-369. doi.org/10.1007/bf00769488
- « Charakteristiky dynamického programovania, príklad, výhody, nevýhody
- Čo je izotermický proces? (Príklady, cvičenia) »

