Štruktúra octanu sodného, vlastnosti, syntéza, použitie

- 2735
- 586
- Alan Milota
On octan sodný Je to sodná soľ kyseliny octovej, ktorej molekulárny vzorec je C2H3Ani2Nat. Skladá sa z delickí bieleho prášku, ktorý je prítomný v podstate v dvoch formách: bezvodý a trihydrát. Obidve sú veľmi rozpustné vo vode, univerzálne rozpúšťadlo; Ale nie tak rozpustné v alkoholoch alebo acetóne.
Forma anhydry má hustotu, bod fúzie a varu s vyššími hodnotami ako hodnoty prezentované trihydrátovou formou octanu sodného. Je to preto, že molekuly vody interferujú medzi interakciami iónov na iónov+ a Ch3Coo-.
 Vzhľad octanu sodného
Vzhľad octanu sodného Acetát sodný je stabilný, najmä ak je uložený medzi 2 a 8 ° C; Je však náchylný na pôsobenie silných oxidačných látok a halogénov.
Môže sa pripraviť reakciou hydrogenuhličitanu sodného s kyselinou octovou. Tiež s reakciou kyseliny octovej s hydroxidom sodným. Obe reakcie sú jednoduché na rozpracovanie a nízke ekonomické náklady; Prvý sa dá urobiť doma.
Táto soľ je trochu toxická zlúčenina. Vytvára podráždenie pokožky, až po častým a nepretržitým kontaktom. Pre oči je to malé dráždivé, ale môže dráždiť dýchacie cesty. Neexistujú žiadne informácie o škodlivom účinku vášho požitia.
Má početné použitie a aplikácie, ktoré zdôrazňuje svoju funkciu tlmenia pH spolu s kyselinou octovou. Acetátový tlmič má PKA = 4,7; ktorý poskytuje vysokú účinnosť v regulácii pH v kyslom prostredí s hodnotami pH medzi 3 a 6.
Vďaka svojej nízkej toxicite a jej vlastnostiam sa široko používa na zvýšenie chuti potravín, ako aj agenta, ktorý poskytuje ochranu pred ich rozkladom v dôsledku ich pôsobenia proti mikróbom.
[TOC]
Štruktúra octanu sodného
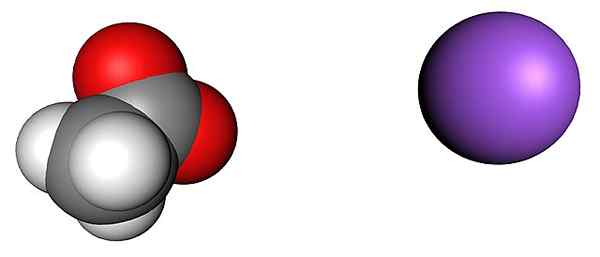 Octu a sodíkový ión. Zdroj: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Octu a sodíkový ión. Zdroj: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Horný obrázok zobrazuje ióny, ktoré tvoria kryštály octanu sodného (bez vody) bezvodý sodný (bez vody). Fialová guľa zodpovedá katiónu+, A molekulárny ión vľavo je acetát, cho3Coo-, So svojimi atómami kyslíka predstavované červenými guľami.
Títo rovesníci, podľa čipu ch3Cesta, sú v pomere 1: 1; Pre každú chorálku3Coo-, Musí existovať katión+ priťahuje jeho negatívne zaťaženie a naopak. Teda atrakcie medzi nimi a odpudenia medzi rovnakým zaťažením nakoniec vytvoria štrukturálne vzorce, ktoré definujú kryštál, ktorého minimálna expresia je jednotková bunka.
Táto jednotná bunka, podobne ako sklo ako celok, sa líši v závislosti od dispozície iónov vo vesmíre; Nie je to vždy rovnaké, dokonca aj pre rovnaký kryštalický systém. Napríklad bezvodý octan sodný môže tvoriť dva ortombické polymorfy, z ktorých jeden je znázornený nižšie:
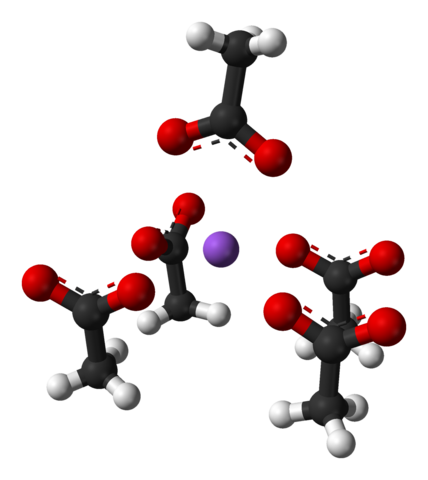 Unitárna bunka octajných kryštálov sodného octanu. Zdroj: Benjah-Bmm27 [verejná doména]
Unitárna bunka octajných kryštálov sodného octanu. Zdroj: Benjah-Bmm27 [verejná doména] Všimnite si usporiadanie iónov: štyri chorí3Coo- Pripojujú NA+ takým spôsobom, že „kreslia“ zdeformovanú štvorcovú základňu pyramídu. Každý z týchto Cho3Coo- zase interagovať s iným NA+ susedný.
Hydratované kryštály
Acetát sodný má veľa afinity k vode; V skutočnosti je to vynikajúce, to znamená, že si zachováva vlhkosť, až kým sa nerozpustí v tom istom. Čím väčšia je vlhkosť, skôr je „tavená“. Je to tak preto3Coo- Ako na+ Môžu hydratovať, obklopovať sa molekulami vody, ktoré vedú ich dipóly k ich zaťaženiu (NA+ Oh2, Chvály3Coo- Hoh).
Môže vám slúžiť: strieborný bromid (AGBR): Štruktúra, vlastnosti a použitiaAk sa táto soľ pripraví v laboratóriu alebo doma, je to taká afinita k vode, že aj pri normálnych teplotách sa už získava ako hydrát; CH3Pata · 3h2Ani. Ich kryštály prestanú byť ortorrombické a stanú sa monoklinickými, pretože teraz začleňujú tri molekuly vody pre každý pár Cho3Coo- a na+.
Vlastnosti
Mená
-Octan sodný.
-Ettanát sodný (IUPAC).
Molárna hmota
-Bezvodý: 82,03 g/mol.
-Trihydratované: 136,03 g/mol.
Aspekt
Vyhodený biely prášok.
Vôňa
Do octu, keď je zahrievaný na rozklad.
Hustota
-Anhidro: 1, 528 g/cm3 pri 20 ° C.
-Trihydratované: 1,45 g/cm3 pri 20 ° C.
Bod topenia
-Anhidro: 324 ° C (615 ° F, 597 K).
-Triohydrát: 58 ° C (136 ° F, 331 K).
Bod varu
-Anhidro: 881,4 ° C (1.618,5 ° F, 1.154,5 k).
-Trihydrát: 122 ° C (252 ° F, 395 K). Rozkladá sa.
Rozpustnosť
Vo vode
-Anhydro: 123,3 g/100 ml pri 20 ° C.
-Trihydratované: 46,4 g/100 ml pri 20 ° C.
V metanole
16 g/100 g pri 15 ° C.
V etanole
5,3 g/100 ml (trihydrát).
Acetón
0,5 g/kg pri 15 ° C.
Kyslosť
PKA: 24 (20 ° C).
Základnosť
PKB: 9.25. Tu je zrejmé, že octan sodný je základnou soľou, ktorá musí mať PKB menej ako jeho PKA.
Index lom (ηd)
1 464
Kaliforka
-100,83 j/mol · k (bezvodý).
-229,9 j/mol · k (trihydrado).
zapaľovač
Nad 250 ° C.
Teplota
600 ° C.
pH
8,9 (roztok 0,1 m až 25 ° C).
Stabilita
Stajňa. Nekompatibilné so silnými a halogénovými oxidačnými činidlami. Vlhkosť.
Reakcie
Acetát sodný môže tvoriť ester reagovaním s halogenidom prenájmu; Napríklad Bromoetano:
Chvály3Potrh +BRCH2Chvály3 => Ch3Kočiary2Chvály3 + Nabr
Acetát sodný je dekarboxyla za vzniku metánu (pyrolýza) v prítomnosti NaOH:
Chvály3Poon +naoh => ch4 + Nat2Co3
Reakcia je katalyzovaná predajom Cesio.
Syntéza
Acetát sodný sa môže vyrábať pri nízkych nákladoch v laboratóriu reagovaním na hydrogenuhličitan sodný s kyselinou octovou:
NAHCO3 + Chvály3Cooh => ch3Cesta +h2Co3
Táto reakcia je sprevádzaná prítomnosťou v roztoku intenzívnej bubliny v dôsledku rozkladu kyseliny uhličitej vo vode a oxidu uhličitého.
H2Co3 => H2Alebo +co2
Priemyselne sa octanové sodný vyrába reakciou kyseliny octovej s hydroxidom sodným.
Chvály3COOH +naOH => ch3Cesta +h2Ani
Žiadosti
Tepelné tašky
Na výrobu tepelných tašiek sa používa octa.
Spočiatku sa soľné kryštály rozpustia v objeme vody na prípravu roztoku, ktorý sa stáva presýteným.
Potom sa zahrieva roztok teploty vyššej ako 58 ° C, čo je jeho topiacim bodom. Presýtený roztok pri teplote miestnosti sa nechá ochladiť a tvorba kryštálov sa nepozoruje; Riešenie je nadmerne -chirp.
Môže vám slúžiť: pravidelná tabuľka, čo je preNeprítomnosť kryštálov je vysvetlená, že tekuté molekuly sú príliš chaotické a nemajú náležité vedenie na dosiahnutie teploty kryštalizácie. Kvapalina je v metastabilnom stave, stav nerovnováhy.
Poskytnúť. V prípade tepelných vreckov.
Keď dôjde k kryštalizácii, teplota sa zvyšuje. Trihydrované kryštály octanu sodného získavajú vzhľad ľadu, ale sú horúce, takže sa nazýva „horúci ľad“.
Priemyselný pracovník
-Acetát sodný sa používa v textilnom priemysle ako mordant v procese farbenia tkaniva
-Neutralizovať odpad z kyseliny sírovej
-Použije sa v spracovaní bavlny na vypracovanie bavlnených vankúšikov, použiteľných pri osobnom čistení a na lekárske účely
-Používa sa v kovovej morenine pred jeho chrómom
-Spolupracuje tak, aby sa v vulkanizácii chloroprénu nevyskytla v procese výroby syntetických kaučukov
-Zasahuje do čistenia glukózy
-Používa sa v opaľovaní kože.
Lekárske použitie
Octat sodný je súčasťou zlúčenín používaných na zásobovanie elektrolytov podávaných pacientom intravenózne.
Používa sa na korekciu hladín sodíka u hyponathemických pacientov, tiež pri korekcii metabolickej acidózy a alkalácie moču.
Tlmiaci roztok
Používa sa ako regulátor pH v mnohých enzymatických reakciách, ktoré sa vyskytujú medzi pH 3 a pH 6.
Rôzne pH roztoku acetátového pufra sa dosahuje zmenou koncentrácie kyseliny octovej a octanu sodného.
Napríklad na získanie pH 4,5 roztok pufra má koncentráciu kyseliny octovej 3,8 g/l a koncentráciu bezvodého octanu sodného 3,0 g/l.
Koncentrácia roztoku acetátu roztoku sa môže zvýšiť, čím sa v rovnakom pomere zvyšuje zložky potrebného roztoku na získanie požadovaného pH.
Acetát/acetonitrilový tlmič sa používa pri kapilárnej elektroforéze pri separácii fotoberberínu.
Výskumné laboratóriá
-Octanu sodný je slabé nukleofilné činidlo, ktoré sa používa pri aniónovej polymerizácii β-laktónu.
-Používa sa ako činidlo v jadrovej magnetickej rezonancii biologických makromolekúl.
-Používa sa pri extrakcii buniek buniek. Sodík je katión, ktorý interaguje s negatívnym zaťažením fosfátov prítomných v DNA, čo pomáha pri kondenzácii. V prítomnosti etanolu tvorí DNA zrazenina, ktorá sa potom môže rozdeliť do vodnej vrstvy.
Ochrana potravín
-Pomáha predchádzať rastu baktérií, okrem zabránenia tvorby nadbytočnej kyslosti, ktorá spôsobuje zhoršenie potravín, a tak zachováva špecifické pH.
-Sodík prítomný v acetáte zvyšuje chuť potravín.
-Acetát sodný sa používa pri príprave zeleninových uhorkov: uhorka, mrkva, cibuľa atď. Okrem toho sa používa pri ochrane mäsa.
Môže vám slúžiť: dimetylanylín: štruktúra, vlastnosti, syntéza, použitieBetón
Betón je poškodený pôsobením vody, ktorý skracuje jej trvanie. Acetát sodný pôsobí ako činidlo betónového tmelu, ktorý ho nepremokaví na vodu, čím predlžuje jeho počiatočné vlastnosti.
Experimenty
Experiment 1
Jednoduchým experimentom je syntéza octanu sodného prostredníctvom reakcie hydrobonátu sodného s octom (5%kyselina octová).
30 ml octu sa umiestni do kadičky a pridá sa približne 3,5 g hydrogenuhličitanu.
V reakcii sa tvorí formy sodíka a kyseliny uhličitej. Kyselina sa rozdeľuje na oxid uhličitý a vodu. Generovanie oxidu uhličitého bude produkovať intenzívnu bublinu v roztoku.
Na zber octanu sodného je spôsobené odparovanie vody, zahrievanie roztoku.
Experiment 2
Ďalším jednoduchým experimentom je tvorba octanu trihydrátu sodného.
Aby sa to dosiahlo, okolo 20 g trihydrátu octanu sodného a umiestneného do kadičky, potom pridanie 10 ml vody a potom pridáte 10 ml vody. Roztok sa zahrieva na teplotu vyššiu ako 58 ° C.
Octanu sodný je úplne rozpustený, aby sa zabezpečilo, že roztok je presýtený. Predtým sa kapsula Pietri umiestni na studený povrch.
Obsah kadičky s trihydrátom octanu v Pietriho kapsule sa pomaly naleje. Teplota kvapaliny v kapsule začína klesať, dokonca aj pod bodom topenia, bez pozorovania kryštalizácie alebo tuhosti octanu trihydrátu sodného sodného.
Zvyčajne na výrobu kryštalizácie trihydratovaného octanu sodného sa pridá malé množstvo soli, ktoré slúži ako kryštalizačné jadro. Inokedy existuje malé narušenie roztoku na začatie kryštalizácie octanu sodného.
Trihydratované kryštály octanu sodného vyzerajú ako ľad, ale ak sa dotknú, bude si všimnúť, že sú relatívne horúce. Z tohto dôvodu sa soľ nazýva „horúci ľad“.
Toxicita
Octat sodný je veľmi malá toxická zlúčenina. Nie je klasifikovaný ako senzibilizátor pre pokožku a dýchacie cesty.
Okrem toho nie je octanom sodný ako mutagénne činidlo v zárodkoch, karcinogénoch alebo toxických bunkách na reprodukciu.
Stručne povedané, pre oči je to malé dráždivé. Dýchacie cesty môžu byť podráždené po ich vdýchnutí. Častý a konštantný kontakt s pokožkou môže spôsobiť podráždenie.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Svetové. (16. januára 2017). Ako pripraviť octanu sodný doma? Obnovené z: média.com
- Národné centrum pre biotechnologické informácie. (2019). Octan sodný. Databáza pubchem. CID = 517045. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Siež. Cameron, K. M. Mannan a M. Ani. Rahman. (1976). Kryštalická štruktúra trihydrátu octanu sodného. Krištáľový akt. B32, 87.
- Wikipedia. (2019). Octan sodný. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (24. januára 2019). Vytvorte horúci ľad z octu a sódy na pečenie. Zotavené z: Thoughtco.com
- Chemická kniha. (2017). Octan sodný. Obnovené z: Chemicalbook.com
- Wasserman Robin. (2019). Použitie octanu sodného. Získané z: Livestrong.com
- Drogová banka. (2019). Octan sodný. Získané z: drogankank.Ac

