Štruktúra octanu acetátu amónneho, vlastnosti, použitia a riziká

- 4913
- 604
- Tomáš Klapka
On Octa Je to anorganická soľ, ktorej chemický vzorec je NH4Chvály3Kohútik. Odchádza zo zmesi kyseliny octovej, ktorá je prítomná v komerčnom octe do 5%koncentrácie a amoniaku. Obe počiatočné látky majú charakteristické pachy, takže je možné získať predstavu o tom, prečo táto soľ vonia ako ocot-amonia.
Najviac vrcholom tejto soli však nie je jej vôňa, ale jej nízka teplota topenia. Je také nízke, že v akomkoľvek laboratóriu by sa dalo získať vo svojej kvapalnej verzii, kde ióny voľne prúdia na prepravu elektrického zaťaženia.
 Amónne octanové kryštály. Zdroj: Vidak [verejná doména].
Amónne octanové kryštály. Zdroj: Vidak [verejná doména]. Na druhej strane je octan amónny chutný; to znamená, že absorbujte vodu alebo vlhkosť prostredia, kým sa úplne nerozpustí. Preto, hoci v bezvodej úrovni sú ich kryštály biele, rýchlo sa jasne (ako sú v kadičke horného obrázka).
Ako solídny zdroj amoniaku musí byť manipulovaný takým spôsobom, aby sa inhalácia jeho výparov minimalizovala. Ale napriek tejto negatívnej charakteristike NH4Chvály3COOH je užitočný na prípravu tlmivých roztokov, ktoré si ponecháva jedlo, zatiaľ čo je súčasťou určitých extraktorov proteínov rozpúšťadiel.
[TOC]
Štruktúra octanu amónneho
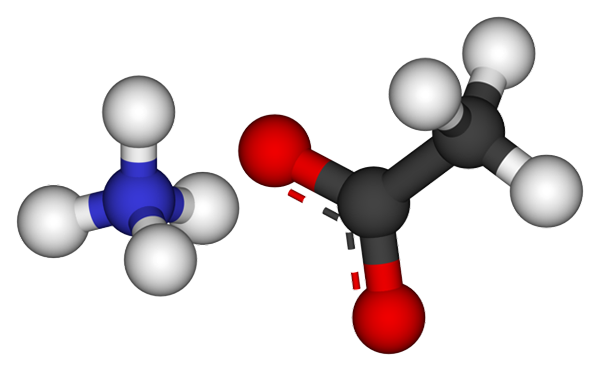 Acetátový ión. Zdroj: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Acetátový ión. Zdroj: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Horný obrázok zobrazuje ióny, ktoré tvoria acetát amónneho v modeli guľôčok a tyčí. Vľavo je katión tetraedrálnej geometrie, NH4+, Zatiaľ čo na pravej strane molekulárny anión s dvoma demokovanými elektrónmi medzi dvoma atómami kyslíka, ch3Coo- (Bodkovaná čiara medzi červenými guľami).
Tak obidva ióny, NH4+ a Ch3Coo-, Zostávajú zjednotení svojou elektrostatickou príťažlivosťou, ktorá spolu s odporom medzi rovnakým zaťažením nakoniec definuje kryštál. Tento kryštál amónneho octanu má orcombickú štruktúru, ktorá sa dá pozorovať v mikroskopických vzorkách alebo dokonca v viditeľných veľkostiach.
Môže vám slúžiť: iónový odkaz: Charakteristiky, ako sa formuje a príkladyNielenže je iónová väzba pre túto soľ dôležitá, ale aj vodíkové mosty. NH4+ Môžete darovať až štyri z týchto mostov; To znamená, že v každom z vrcholov jeho tetraedronu je atóm kyslíka od Cho3Coo- sused (h3N+-H-OCH3).
Teoreticky by si potom mali byť sily vo vnútri ich kryštálov veľmi silné; Ale experimentálne sa vyskytuje opak, pretože sa topí iba 114 ° C. Preto vodíkové mosty nekompenzujú slabosť ich iónovej väzby, ani nízku sietnicovú energiu NH ortorrhrombického skla4Chvály3Coo.
Ostatné kompozície a voda
Na začiatku sa povedalo, že octan amónny sa pripravuje zmiešaním kyseliny octovej a amoniaku. Preto sa soľ môže vyjadriť aj ako: NH3Chvály3Kohútik. V závislosti od zloženia je možné získať ďalšie štruktúry: NH3· 23Cooh, o nh3· 53Napríklad Cooh.
Uviedlo sa tiež, že absorbuje dostatok vlhkosti. Pritom zahŕňa molekuly vody do svojich kryštálov, ktoré sú hydrolyzované a dáva NH3 alebo CH3Cooh; Preto soľ emituje vôňu amoniaku alebo octu.
Vlastnosti
Fyzický vzhľad
Delicescentné biele kryštály s vôňou octu a amoniaku.
Molárna hmota
77 083 g/mol.
Hustota
1 073 g/ml pri 25 ° C.
Bod topenia
114 ° C. Táto hodnota je podstatne nižšia v porovnaní s inými soľami alebo iónovými zlúčeninami. Okrem toho chýba bod varu v dôsledku tvorby amoniaku, čo znamená rozklad soli.
Rozpustnosť
143 g/100 ml pri 20 ° C. Všimnite si svoju mimoriadnu rozpustnosť vody, ktorá demonštruje afinitu, ktorú molekuly vody cítia na iónov NH4+ a Ch3Coo-, Hying vo vodných sférach.
Môže vám slúžiť: pravidlá Hume-RotheryJeho rozpustnosť nie je taká v menších polárnych rozpúšťadlách. Napríklad v 100 ml metanolu pri 15 ° C 7,89 g NH sa rozpustí4Chvály3Coo.
Stabilita
Je to vynikajúce, takže by ste sa mali vyhnúť skladovaniu vo vlhkých priestoroch. Aj pri absorbovaní vody oslobodzuje amoniak, a preto sa rozkladá.
Pka
9.9.
Táto konštanta zodpovedá kyslosti iónu amónneho:
NH4+ + B NH3 + HB
Kde HB je slabá kyselina. Ak je základňa B vodou, jej hydrolytická reakcia bude reakciou:
NH4+ + H2Alebo NH3 + H3Ani+
V ktorom druh H3Ani+ Definujte pH roztoku.
Na druhej strane acetát tiež prispieva k pH:
Chvály3Coo- + H2Alebo CH3COOH + OH-
Tak oba druhy h3Ani+ a oh- Sú neutralizované tým, že dávajú pH 7, neutrálne. Podľa Pubchem však majú vysoko koncentrované roztoky octanu amónneho kyslého pH; čo znamená, že NH hydrolýza prevláda4+ O výberu3Coo-.
Štandardná výcvik
ΔFH298 = -615 kJ/mol.
Žiadosti
Analytický
Vodné roztoky octanu sodného umožňujú solubilizáciu síranov olova, železa a zinku, aby sa následne stanovila ich koncentrácia pomocou atómovej absorpčnej spektroskopie.
Polovičný vodič
Ako nízkoteplotné jedlá v porovnaní s inými soľami sa jej kvapalina môže použiť na pohon elektrického prúdu, ktorý sa otočí na obvode žiarovky.
Nárazník
Môžete regulovať zmeny pH v kyslých alebo základných intervaloch, ktoré sa používajú na udržanie konštantného pH, napríklad na mäso, čokolády, syry, zeleninu alebo iné potravinové výrobky.
Môže vám slúžiť: molybdénNa ľade a podlahe
Je to biologicky odbúrateľná a relatívne lacná soľ, ktorá sa používa na odmrazovanie ľadových ciest. Tiež, pretože je zdrojom dusíka rozpustného vo vode, je určený na poľnohospodárske použitie na stanovenie hladín draslíka.
Precipitačný prostriedok
Táto soľ sa používa na zrážanie proteínu na vykonanie chromatografickej analýzy.
Liek
Amónny octan funguje ako veterinárne diuretické činidlo a je tiež nevyhnutnou soľou pre syntézu inzulínu a penicilínu.
Riziká
Ďalej a nakoniec sú uvedené niektoré negatívne riziká alebo dôsledky spôsobené octom amónnym:
- Môže na pokožke vytvárať mierne podráždenie, ale bez absorbovania v nej.
- Po požití spôsobuje žalúdok, hnačka, diuréza, úzkosť, väčšia potreba močenia, chvenie a ďalšie príznaky súvisiace s otravou amoniakom, ako aj poškodenie pečene.
- Jeho vdýchnutie dráždi nos, hrdlo a pľúca.
Zvyšok nie je známe, či môže rakovina generovať a akékoľvek možné riziko požiaru touto soľou sa vyradí (aspoň za normálnych podmienok skladovania).
Odkazy
- Rybáčik. (1967). Štúdie vodíkovej väzby. Xiv. Kryštalická štruktúra octanu amónneho. Inštitút chémie, University of Uppsala, Uppsala, Švédsko. Krištáľový akt. 23, 956.
- Národné centrum pre biotechnologické informácie. (2019). Octa. Databáza pubchem. CID = 517165. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Sullivan Randy. (2012). Vodivosť octanu. Získané z: Chemdemos.Uorgon.Edu
- Viacchem, Ltd. (s.F.). Octa. Získané z: Viacheminc.com
- Wikipedia. (2019). Octa. Zdroj: In.Wikipedia.orgán
- Ministerstvo zdravotníctva v New Jersey. (2012). Octan amónny: Informačný list o nebezpečných látkach. [PDF]. Získané z: NJ.Vláda
- Xueyanghu. (s.F.). Použitia a riziká octanu amónneho. Obnovené z: xueyanghu.Slovník.com
- « Charakteristiky alizarínu, príprava, použitie a toxicita
- Štruktúra, vlastnosti a použitie hydroxidu železa (III) »

