Absorbancia Čo je, príklady a cvičenia vyriešené
- 1627
- 195
- Gabriel Bahna
Ten absorpcia Je to logaritmus s negatívnym príznakom kvocientu medzi intenzitou vznikajúceho svetla a intenzitou dopadu na svetlo na vzorke priesvitného roztoku, ktorý bol osvetlený monochromatickým svetlom. Tento kvocient je priepustnosť.
Fyzický proces prechodu svetla cez vzorku sa nazýva svetelný prenos, A absorbancia je jeho miera. Absorbancia sa preto stáva najmenším logaritmom priepustnosti a je dôležitou skutočnosťou na určenie koncentrácie vzorky, ktorá sa všeobecne rozpustí v rozpúšťadle, ako je voda, alkohol alebo akékoľvek iné.
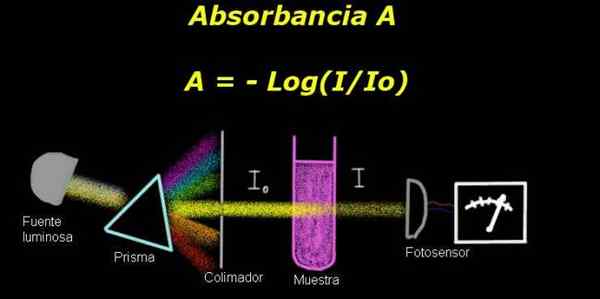
 postava 1. Schéma procesu absorbancie. Pripravený spoločnosťou F. Zapata
postava 1. Schéma procesu absorbancie. Pripravený spoločnosťou F. Zapata Na meranie absorbancie je potrebné zariadenie Elektrofotometer, s ktorým sa meria prúd, ktorý je úmerný dopadu na svetelnú intenzitu na jeho povrchu.
Pri výpočte priepustnosti sa všeobecne meria signál intenzity zodpovedajúceho samotnému rozpúšťadlu a tento výsledok sa zaznamenáva ako Io.
Potom sa vzorka rozpustila v rozpúšťadle s rovnakými podmienkami osvetlenia. Opatrenie merané elektrofotometrom je označené ako Jo, čo vám umožňuje vypočítať priepasť Tón Podľa nasledujúceho vzorca:
T = i / iani
Je to uvoľnené množstvo. Ten Absorbancia a Toto je vyjadrené ako:
A = - log (t) = - log (i / iani)
[TOC]
Molárna absorbancia a absorbácia
Molekuly, ktoré tvoria chemikálie, sú schopné absorbovať svetlo a miera je presne absorbancia. Je to výsledok interakcie medzi fotónmi a molekulárnymi elektrónmi.
Preto je to veľkosť, ktorá bude závisieť od hustoty alebo koncentrácie molekúl, ktoré tvoria vzorku a tiež optickú cestu alebo vzdialenosť prejdené svetlom.
Môžete vám slúžiť: Newtonov tretí zákon: Aplikácie, experimenty a cvičeniaExperimentálne údaje naznačujú, že absorbancia Do je lineárne úmerný koncentrácii C a vzdialenosť d Svetlo cestovalo. Na jeho výpočet na základe týchto parametrov je možné vytvoriť nasledujúci vzorec:
A = ε⋅c⋅d
V predchádzajúcom vzorec, ε Je to konštanta proporcionality známa pod menom Molárne absorbovanie.
Molárna absorbita závisí od typu látky a vlnovej dĺžky, s ktorou sa meraná absorbancia. Ten Molárne absorbovanie Je tiež citlivý na teplotu vzorky a jej pH.
Zákon
Tento vzťah medzi absorbanciou, absorbitou, koncentráciou a vzdialenosťou od hrúbky cesty, ktorú svetlo nasleduje vo vzorke, je známy ako zákon o pive-lambert.
 Obrázok 2. Zákon o pive - Lambert. Zdroj: f. Zapata,
Obrázok 2. Zákon o pive - Lambert. Zdroj: f. Zapata, Nižšie je niekoľko príkladov, ako ho používať.
Príklady
Príklad 1
Počas experimentu vzorka s červeným svetlom laserových svetiel hélium, ktorých vlnová dĺžka je 633 nm. Elektrotometer meria 30 mV, keď laserové svetlo ovplyvňuje priamo a 10 mV, keď prechádza vzorkou.
V tomto prípade je priepustnosť:
T = i / io = 10 mV / 30 mV = ⅓.
A absorbancia je:
A = - log (⅓) = log (3) = 0,48
Príklad 2
Ak je rovnaká látka umiestnená v nádobe, ktorá má polovicu hrubej.
Musí sa uvažovať o tom, že ak sa hrúbka zníži na polovicu, potom absorbancia, ktorá je úmerná optickej hrúbke, klesá o polovicu, znamená to a = 0,28. Tony prenos sa poskytne nasledujúcim vzťahom:
Môže vám slúžiť: vertikálny záber: vzorce, rovnice, príkladyT = 10-A = 10^(-0.28) = 0,53
Elektrotometer bude označovať 0,53*30 mV = 15,74 mV.
Vyriešené cvičenia
Cvičenie 1
Je potrebné určiť molárnu absorbálnosť určitej patentovanej zlúčeniny, ktorá je v roztoku. Z tohto. Vzorka sa umiestni na hrubú 1,50 cm.
Je založený na koncentračnom roztoku 4,00 x 10^-4 mol na liter a meria sa priepustnosť, čo vedie k 0,06. Určite s týmito údajmi molárnu absorpciu vzorky.
Riešenie
V prvom rade sa určuje absorbancia, ktorá je definovaná ako najmenej logaritmu založená na desiatej priepustnosti:
A = - log (t)
A = - log (0,06) = 1,22
Potom sa používa zákon Lambertovho piva, ktorý vytvára vzťah medzi absorbanciou, molárnou absorbáciou, koncentráciou a optickou dĺžkou:
A = ε⋅c⋅d
Vyčistenie molárnej absorbity Získa sa nasledujúci vzťah:
ε = a/(clekd)
výmena daných hodnôt:
ε = 1,22/(4,00 × 10^-4 m⋅1,5 cm) = 2030 (m⋅cm)^-1
Predchádzajúci výsledok bol zaokrúhlený na tri významné číslice.
Cvičenie 2
Aby sa zlepšila presnosť a určila chybu miery molárneho absorbovania vzorky vo cvičení 1, vzorka sa postupne zriedi do polovice koncentrácie a priepustnosť sa meria v každom prípade.
Počnúc od CO = 4 × 10^-4 m s priepustnosťou t = 0,06 sa získa nasledujúca sekvencia údajov pre priepustnosť a absorbanciu vypočítanú z priepustnosti:
Co/1-> 0,06-> 1,22
CO/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
CO/8-> 0,71-> 0,15
CO/16-> 0,83-> 0,08
CO/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
CO/128-> 0,98-> 0,01
CO/256-> 0,99-> 0,00
S týmito údajmi urobte:
Môže vám slúžiť: stacionárne vlny: vzorce, charakteristiky, typy, príkladya) graf absorbancie založený na koncentrácii.
b) lineárne nastavenie údajov a nájdite sklon.
c) Zo získanom sklonu vypočítajte molárnu absorbáciu.
Riešenie
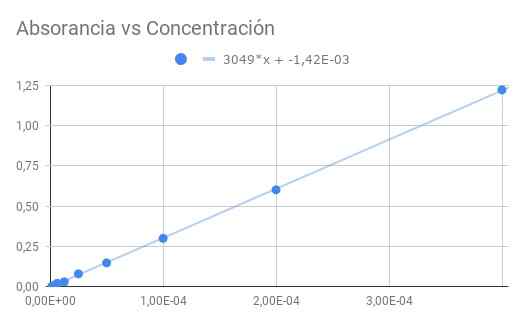 Obrázok 3. Absorbancia verzus koncentrácia. Zdroj: f. Zapata.
Obrázok 3. Absorbancia verzus koncentrácia. Zdroj: f. Zapata. Získaný sklon je produkt molárnej absorpcie optickou vzdialenosťou, takže rozdelenie sklonu podľa dĺžky 1,5 cm Získame molárne absorbovanie
ε = 3049/1,50 = 2033 (m⋅cm)^-1
Cvičenie 3
S údajmi o cvičení 2:
a) Vypočítajte absorpciu pre každé údaje.
b) Stanovte priemernú hodnotu pre molárnu absorbita, jej štandardnú odchýlku a štatistickú chybu spojenú s priemerom.
Riešenie
Molárne absorbovanie sa vypočíta pre každú z testovaných koncentrácií. Pripomeňme, že podmienky osvetlenia a optická vzdialenosť zostávajú pevné.
Výsledky molárnej absorbity sú:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1 872, 1862 v jednotkách 1/(m*cm).
Z týchto výsledkov môžeme mať priemernú hodnotu:
= 1998 (m*cm)^-1
So štandardnou odchýlkou: 184 (m*cm)^-1
Priemerná chyba je štandardná odchýlka vydelená druhou odmocninou čísla údajov, to znamená:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Nakoniec sa dospelo k záveru, že patentovaná látka má molárny absorbujúci pri frekvencii 589 nm produkovanej sodíkovou lampou:
= (2000 ± 60) (m*cm)^-1
Odkazy
- Atkins, str. 1999. Fyzikálna chémia. Vydanie omega. 460-462.
- Sprievodca. Prenos a absorbancia. Získané z: chémie.LAGUIA2000.com
- Environmentálna toxikológia. Priepustnosť, absorbancia a zákon Lamberta. Získané z: úložiska.Inovácia.je
- Dobrodružná fyzika. Absorpcia a priepustnosť. Získané z: rpfisica.Blog.com
- Sistofotometria. Získané z: Chem.Librettexts.orgán
- Environmentálna toxikológia. Priepustnosť, absorbancia a zákon Lamberta. Získané z: úložiska.Inovácia.je
- Wikipedia. Absorpcia. Získané z: Wikipedia.com
- Wikipedia. Spektrofotometria. Získané z: Wikipedia.com
- « Latinskoamerický avant -garde kontext, charakteristiky, autori
- Totalitarizmus pôvod, charakteristiky, príčiny a dôsledky »

