50 príkladov kyselín a základní

- 3188
- 290
- Tomáš Klapka
Sú stovky Príklady kyselín a základní ktoré sa nachádzajú vo všetkých odvetviach chémie, ale že ako celok sú rozdelené do dvoch veľkých rodín: anorganické a organické. Anorganické kyseliny sa zvyčajne nazývajú minerálne kyseliny, ktoré sa vyznačujú obzvlášť silnou v porovnaní s organickými.
Kyseliny a základne sa chápu ako látky, ktoré majú poľnohospodárske príchute alebo saponáceos, respektíve. Obidve sú korozívne, hoci slovo „žieravé“ sa zvyčajne používa pre silné základne. Stručne povedané. Jeho charakteristiky v solventných médiách naplánovali sériu definícií v celej histórii.
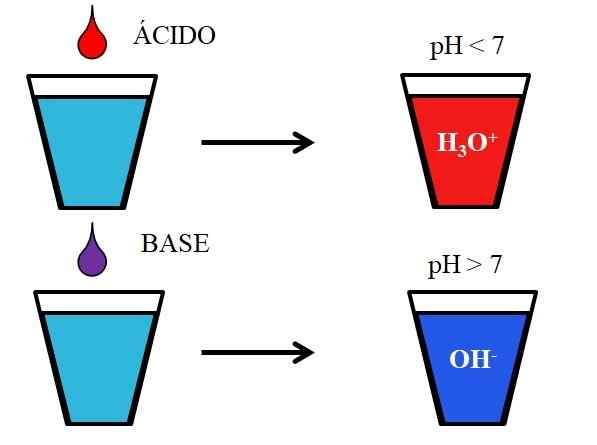 Správanie kyselín a báz, keď sa rozpustí vo vode. Zdroj: Gabriel Bolívar.
Správanie kyselín a báz, keď sa rozpustí vo vode. Zdroj: Gabriel Bolívar. Spodný obrázok ukazuje generické správanie kyselín a báz, keď sú pridané alebo rozpustené v pohári s vodou. Kyseliny produkujú roztoky s hodnotami pH pod 7 v dôsledku hydronios iónov, h3Ani+; Zatiaľ čo základy produkujú roztoky s pH nad 7 v dôsledku hydroxylových iónov (alebo oxydrilu), OH-.
Ak pridáme kyselinu chlorovodíkovú, HCl (červená kvapka), do skla, budú H ióny3Ani+ a cl- hydratovaný. Na druhej strane, ak opakujeme experiment s hydroxidom sodným, NaOH (fialová kvapka), budeme mať OH ióny- a na+.
[TOC]
Definície

Charakteristiky, čoraz viac študované a chápané, kyselín a báz stanovili viac ako jednu definíciu pre tieto chemické zlúčeniny. Medzi týmito definíciami máme Arrhenius, Bronsted-Lowry a nakoniec Lewisa. Pred citovaním príkladov je potrebné mať to jasné.
Arrhenius
Kyseliny a základne sú podľa Arrhenius3Ani+ alebo oh-, respektíve. To znamená, že obrázok už predstavuje túto definíciu. Samotný však opovrhuje príliš slabé kyseliny alebo základne, aby vyrobil takéto ióny. Tam vstupuje definícia Bronsted-Lowry.
Môže vám slúžiť: kyseliny: Charakteristiky a príkladyBronsted slowry
Kyseliny bronsted-liwry sú tie, ktoré môžu darovať ióny h+, A základne sú tie, ktoré ich prijímajú h+. Ak kyselina veľmi ľahko daruje+, To znamená, že je to silná kyselina. To isté platí pre základne, ale akceptujete H+.
Máme teda silné alebo slabé kyseliny a bázy a ich sily sa merajú v rôznych rozpúšťadlách; Najmä vo vode, z ktorých sú známe jednotky pH (od 0 do 14).
Preto silná kyselina bude úplne darovať svoju h+ do vody v reakcii typu:
Ha + h2O => a- + H3Ani+
Kde- Je to konjugovaný základ Ha. Odtiaľto teda prichádza H3Ani+ prítomný v skle s kyslým roztokom.
Medzitým slabá základňa B nechráni vodu, aby získala svoju príslušnú H+:
B + h2Alebo HB + OH-
Kde HB je konjugovaná kyselina B. Toto je prípad amoniaku, NH3:
NH3 + H2Alebo NH4+ + Oh-
Veľmi silná základňa môže priamo darovať OH ióny- Nie je potrebné reagovať s vodou; Rovnako ako na naoh.
Lesk
Nakoniec, Lewis kyseliny sú tie, ktoré vyhrávajú alebo prijímajú elektróny, a Lewisove základne sú tie, ktoré darujú alebo strácajú elektróny.
Napríklad základňa Bronsted-Lowry NH3 Je to tiež Lewisová základňa, pretože atóm dusíka akceptuje H+ Darovaním tohto páru bezplatných elektrónov (h3N: h+). Z tohto dôvodu tieto tri definície nesúhlasia medzi sebou, ale vzájomne sa prelínajú a pomáhajú študovať kyslosť a základnosť v širšom spektre chemických zlúčenín.
Môže vám slúžiť: nikel: História, vlastnosti, štruktúra, použitie, rizikáPríklady kyselín
Po objasnení definícií bude séria kyselín uvedená nižšie s ich príslušnými vzorcami a názvami:
-HF: Kyselina fluorhydrová
-HBR: Kyselina bromhydrová
-Ahoj: Kyselina yodhydrová
-H2S: kyselina sulfhydrová
-H2SE: Kyselina seleenhydrová
-H2TE: kyselina telurhydrová
Jedná sa o binárne kyseliny, tiež nazývané hydraceidy, ktoré patrí do vyššie uvedenej kyseliny chlorovodíkovej, HCL.
-Hned3: kyselina dusičná
-Hned2: Kyselina dusná
-HNO: kyselina hyponitrous
-H2Co3: Kyselina uhličitá
-H2Co2: Kyselina uhlíka, ktorá je v skutočnosti známa viac pod názvom kyseliny mravčej, HcoOH, najjednoduchšia organická kyselina zo všetkých
-H3Po4: kyselina fosforečná
-H3Po3 alebo h2[HPO3]: Kyselina fosfor, s väzbou H-P
-H3Po2 alebo h [h2Po2]: kyselina hypofosférka, s dvoma väzbami H-P
-H2SW4: kyselina sírová
-H2SW3: Kyselina sírna
-H2Siež2Ani7: Kyselina disulfurová
-Hio4: kyselina periódová
-Hio3: Kyselina yodia
-Hio2: kyselina jodóza
-Hio: kyselina hypoyodoso
-H2Croch4: Kyselina chromová
-Hmno4: Kyselina manganová
-Chvály3COOH: kyselina octová (ocot)
-Chvály3SW3H: Kyselina metanosulfónová
Všetky tieto kyseliny, s výnimkou Formic a posledných dvoch, sú známe ako oxácidos alebo ternárne kyseliny.
Ostatné:
-Alcl3: hliníkový chlorid
-Fecl3: chlorid železitý
-Bf3: Boro trifluoruro
-Kovové katióny rozpustené vo vode
-Karboce
-H (chbjedenásťCljedenásť): Super kyslý Carborano
- Fso3H: Kyselina fluórsulfónová
- Hsbf6: Kyselina fluórntimónová
- Fso3H · sbf5: Kúzla kyselina
Posledné štyri príklady tvoria hrôzostrašné super kyseliny; Zlúčeniny schopné rozpadať takmer akýkoľvek materiál sotva sa ho dotýkať. Alcl3 Je to príklad kyseliny Lewis, pretože centrum hliníka kovu je schopné prijať elektróny kvôli svojmu elektronickému nedostatku (nedokončí svoj oktet Valencia).
Môže vám slúžiť: Merkúrový hydroxid: Štruktúra, vlastnosti, použitie, rizikáPríklady základní
Medzi anorganické základne máme kovové hydroxidy, ako je hydroxid sodný, a niektoré molekulárne hydurns, ako je už citovaný amoniak. Tu sú ďalšie príklady základov:
-KOH: hydroxid draselný
-LIOH: hydroxid lítium
-RBOH: Rubidio Hydroxid
-CSOH: Hydroxid cesium
-FROH: Francio Hydroxid
-Byť (oh)2: beryl hydroxid
-Mg (oh)2: hydroxid horčík
-CA (OH)2: Hydroxid vápenatý
-SR (OH)2: Stronciový hydroxid
-Ba (oh)2: hydroxid bária
-Ra (oh)2: rádiový hydroxid
-Viera (oh)2: Hydroxid železitý
-Viera (oh)3: železitý hydroxid
-Al (oh)3: Hliníkový hydroxid
-Pb (OH)4: Plúmbický hydroxid
-Zn (oh)2: zinkový hydroxid
-CD (OH)2: Kadmium hydroxid
-Cu (oh)2: Cupric Hydroxid
-Ti (oh)4: titánový hydroxid
-PH3: fosfín
-Popolček3: Arsina
-Nanh2: sodík amiduro
- C5H5N: pyridín
-(Ch3) N: trimetylamín
- C6H5NH2: Fenylamín alebo anilín
-NAH: Hydrid sodný
-KH: Hydrid draslíka
-Karbanónia
-Li3N: Dusičnan lítium
-Alcoxidy
-(CH3)2Ch]2NLI: diisopropilamid lítia
-Dietinilbenzén anión: C6H4C42- (Doteraz najsilnejšia základňa známa)
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Naomi Hennah. (10. októbra 2018). Ako učiť kyseliny, základne a solí. Získané z: edu.Rsc.orgán
- HelMestine, Anne Marie, PH.D. (31. augusta 2019). Vzorce bežných kyselín a báz. Zotavené z: Thoughtco.com
- David Wood. (2019). Porovnajte spoločné kyseliny a základy. Štúdium. Získané z: štúdie.com
- Ross Pomeroy. (23. augusta 2013). Najsilnejšie kyseliny na svete: Rovnako ako oheň a ľad. Obnovené z: RealClearScience.com
- Wikipedia. (2019). Dialón. Zdroj: In.Wikipedia.orgán
- « Symboly a vzorce priemeru, ako to vytiahnuť, obvod
- Ekofyziológia Aké štúdie a aplikácie u zvierat a zeleniny »

