Nemetalické oxidy

- 4321
- 1205
- Adrián Fajnor
 Oxid uhličitý je skleníkový plyn a je tiež nemetalickým oxidom
Oxid uhličitý je skleníkový plyn a je tiež nemetalickým oxidom Čo sú ne -metalické oxidy?
Ten nemetalické oxidy Sú to binárne zlúčeniny vytvorené medzi net -kov s pozitívnym oxidačným stavom a kyslíkom s oxidačným stavom -2. Tieto zlúčeniny sa tiež nazývajú anhydridy a oxidy kyselín, ktoré tvoria kyslé roztoky ich rozpustením vo vode a tiež majú tendenciu reagovať so základnými oxidmi za vzniku oxizálnych solí.
Neoverné oxidy sú svojou povahou veľmi bežné. V skutočnosti sú všade. Voda, vitálna tekutina, ktorá pokrýva dve tretiny zemského povrchu, je nemetalický oxid. Rovnako sú oxid uhličitý, ktoré vydýchneme počas nášho dýchania a oxidov síry, ktoré kontaminujú vzduch a ktoré spôsobujú kyslý dážď.
Keďže sa tvoria nemetály a kyslík (ktorý je tiež nemetal), odkazy, ktoré spájajú ich atómy, sú vo väčšine polárnych prípadov kovalentné väzby. Z tohto dôvodu má drvivá väčšina nemetalických alebo anhydridových oxidov značne nízkym varom a mnohé z nich sú plyny pri teplote miestnosti.
Vlastnosti nemetalických oxidov
- Nemajú lesk alebo kovový lesk.
- Môžu mať rôzne farby.
- Ich atómy sú zjednotené pomocou kovalentných väzieb namiesto iónových väzieb.
- Sú tvorené kyslíkom a ne -metal.
- V porovnaní s oxidmi kovov majú zvyčajne nízke body topenia a varu, aj keď veľmi rozmanité.
- Väčšina z nich sú plyny, ale možno sa nachádzať aj v tuhom stave (napríklad n2Ani3) alebo kvapalina pri izbovej teplote.
- Pevné ne -metalické oxidy sú zvyčajne krehké a môžu mať inú tvrdosť.
- Sú to zlé vodiče tepla a elektriny.
- Pri ich rozpustení vo vode reagujú na vytvorenie oxacidových kyselín.
- Niektoré z jej oxacidových kyselín sú silné kyseliny, ktoré majú tendenciu tvoriť anióny alebo oxyániá vo vodnom roztoku.
- Reagujú so základnými oxidmi za vzniku oxizálnych solí.
Typy ne -metalických oxidov
Neexistuje žiadna formálna alebo všeobecne akceptovaná klasifikácia nemetalických oxidov. Tieto môžu byť však zoskupené podľa ich vlastností na báze kyseliny.
Aj keď sa nemetalické oxidy nazývajú aj oxidy kyselín, nie všetky vždy reagujú ako kyseliny proti iným zlúčeninám. Vzhľadom na to je možné identifikovať tri rôzne typy nemetalických oxidov podľa ich kyslých/bázických vlastností:
Oxidy kyseliny nemetarovej
Sú najbežnejšie. Prevažná väčšina zlúčenín medzi kyslíkom a iným net -kovovým, bez ohľadu na ich oxidačný stav, produkuje minerálne kyseliny pri ich rozpustení vo vode, čo vedie k roztokom kyselín.
- Niektoré príklady oxidov kyselín sú anhydrid dusičnan (n2Ani5) a sulfurský anhydrid (tak3).
Neutrálne nemetalické oxidy
Niektoré nemetalické oxidy nereagujú s vodou, keď sa v ňom rozpúšťajú. V týchto prípadoch je výsledný roztok neutrálny (nie je ani kyslý ani základný).
- Niektoré príklady neutrálnych oxidov sú oxid uhoľnatý (CO), oxid dusný (N₂O) a oxid chloričitého (CLO2).
Nemetalické amfotoónové oxidy
Termín Anfótero Vzťahuje sa na schopnosť chemickej zlúčeniny správať sa ako kyselina alebo báza, v závislosti od toho, na čo reaguje. To znamená, že ide o zlúčeniny, ktoré sú súčasne kyseliny aj bázy.
- Medzi amfotickými nemetalickými oxidmi je najbežnejšia voda (h2Buď). Voda je amfotentná, pretože je schopná dať protón základne (pôsobiacej ako kyselina), ale je tiež schopná dostať protón kyseliny (pôsobí ako báza).
Príklady ne -metalických oxidov
Najbežnejšie nemetalické oxidy každého nemetalu sú uvedené nižšie, spolu s molekulárnym vzorcom, jeho názov podľa systematickej nomenklatúry IUPAC, podľa nomenklatúry zásob a podľa tradičnej nomenklatúry:
Oxidy uhlíka
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
Co | Oxid uhoľnatý | Oxid uhličitý (II) | Anhydrid uhlíka |
CO2 | Oxid uhličitý | Oxid uhličitý (IV) | Anhydrid uhála |
Oxidy dusíka
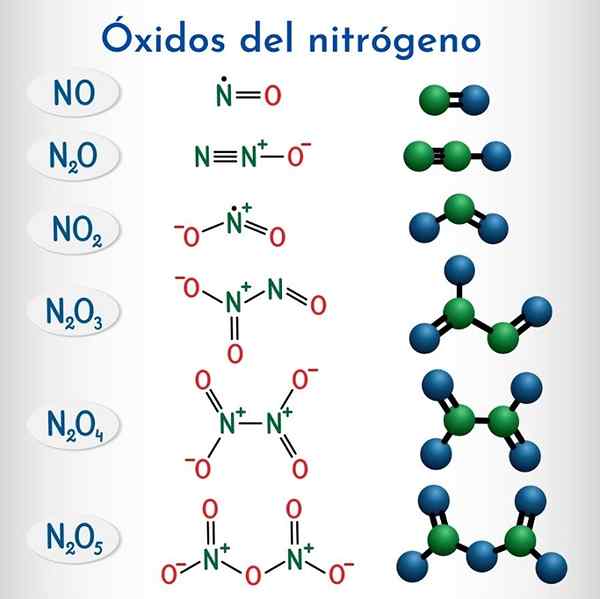 Vzorce a štruktúry 6 nemetalických oxidov dusíka
Vzorce a štruktúry 6 nemetalických oxidov dusíka Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
N2o | Oxid dinitrogénu | Oxid dusíka (I) | Oxid dusný (Hiponitroso anhydrid) |
Nie | Oxid dusíka | Oxid dusíka (II) | Oxid dusnatiny |
N2o3 | Oxid dinitrogénu | Oxid dusíka (III) | Anhydrid dusíka |
N2o4 | Tetraxid dinitrogénu | Oxid dusíka (IV) | Tetraxid dusíka |
No2 | Oxid dusíka | Oxid dusíka (IV) | Oxid dusíka |
N2o5 | Pentaoxid dinitrogénu | Oxid dusíka (V) | Anhydrid dusičky |
Oxidy fosforu
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
P2O3 | Dioroxid pre diverznosť | Oxid fosfor (III) | Anhydrid fosforu |
P2O5 | Difosfázový pentaoxid | Oxid fosfor (V) | Anhydrid fosforečky |
P2O4 | Difosphack tetraxid | Oxid fosfor (III, V) | --- |
Oxidy arzénu
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
AS2O3 | Denný oxid | Oxid arzénu (III) | Anhydrid arzenioso |
AS2O5 | Demokerický pentaoxid | Oxid arzénu (V) | Anhydrid arzénu |
Oxidy antimónov
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
SB2O3 | Trik | Oxid antimónia (III) | Antimhydrid |
SB2O5 | Diantimónia pentaoxid | Oxid antimónu (V) | Antimonická anhydrid |
Oxidy síry
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
SW | Oxid síry | Oxid síry (II) | Hyposulfurózne anhydrid |
SO2 | Oxid | Oxid síry (IV) | Anhydrid síry |
SO3 | Oxid síry | Oxid síry (VI) | Anhydrid |
Oxidy selénu
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
SEO | Oxid selénu | Oxid selénu (II) | Anhydrid hypiplanín |
SEO2 | Oxid seléniu | Oxid selénu (IV) | Anhydrid |
SEO3 | Oxid selénu | Oxid selénu (VI) | Anhydrid selénic |
Oxidy telurio
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
Teo | Oxid telurio | Oxid telurio (II) | Anhydrid hypelurózne |
Teo2 | Oxid telurio | Oxid telurio (IV) | Anhydrid |
Teo3 | Oxid telurio | Oxid telurio (VI) | Anhydrid |
Oxidy chlóru
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
Cl2o | Oxid chlóru | Oxid chlóru (I) | Hypokrórny anhydrid |
CL2O3 | Oxid chlóru | Oxid chlóru (III) | Chlórový anhydrid |
CL2O5 | Chlór pentaoxid | Oxid chlóru (V) | Chlorický anhydrid |
CL2O7 | Heptoxid chlóru | Oxid chlóru (VII) | Zadok |
Oxidy
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
Br2o | Oxid brómy | Oxid brómy (I) | Anhydrid |
BR2O3 | Oxid brómy | Oxid brómy (III) | Bromádový anhydrid |
BR2O5 | Pentaoxid bróma | Oxid brómy (V) | Anhydrid bróm |
BR2O7 | Brómový heptaoxid | Oxid brómy (VII) | Anhydrid perbromu |
Oxidy jódu
Vzorec | Systematický názov IUPAC | Nomenklatúra | Tradičný názov |
I2o | Jódový oxid | Oxid jód (I) | Anhydrid hypoyodoso |
I2o3 | Trioxid jódu | Oxid jód (III) | Anhydrid yodoso |
I2o5 | Jódový pentaoxid | Oxid jód (V) | Anhydrid jodia |
I2o7 | Jódový heptoxid | Oxid jód (VII) | Anhydrid periódioa |

