Štruktúra chrómového oxidu (III), nomenklatúra, vlastnosti, použitie

- 833
- 66
- MUDr. Miloslav Habšuda
On Oxid chróm (III) U chrómový oxid je anorganická zelená tuhá látka, ktorá sa tvorí spaľovaním kovu chrómu (CR) v kyslíku (alebo2), ponechanie chrómu s oxidačným stavom 3+. Jeho chemický vzorec je cr2Ani3. V prírode sa nachádza v mineráli Eskolaíta. Prírodné ložiská chrómového oxidu (III) nie sú známe.
Môže sa pripraviť okrem iného zahrievaním CR2Ani3 hydratovaný (cr2Ani3.NH2O) na úplné odstránenie vody. Získa sa tiež ako produkt kalcinácie oxidu chrómu (VI) (CRO3).
 Chrómový oxid pigment (III). FK1954 [verejná doména]. Zdroj: Wikipedia Commons
Chrómový oxid pigment (III). FK1954 [verejná doména]. Zdroj: Wikipedia Commons Najlepším spôsobom, ako ho získať čisto, je rozklad dichromátu amónneho (NH4)2Cr2Ani7 pri 200 ° C. Priemyselne sa vyrába znížením dichromátu sodného (NA2Cr2Ani7) pevná so síry.
Keď je jemne rozdelený, predstavuje jasne zelenú farbu so žltkastým nuanciou. Ale ak sú častice väčšie, vykazuje moderné farbivo. Chromický oxid je najstabilnejší zelený pigment, ktorý je známy. Jeho tepelná a chemická odolnosť z neho robí cenné keramické farbivo.
Používa sa v priemyselných povlakoch, lakoch, v stavebnom priemysle, v šperkoch, ako sfarbenie v kozmetike alebo vo farmaceutických výrobkoch, okrem iného.
[TOC]
Štruktúra
Oxid a-CR2Ani3 Má štruktúru typu Corindon. Jeho kryštalický systém je rhomboonický šesťuholník. Je izomorfný s a-aluminou a a-Fe2Ani3.
Eskolaíta, prírodný minerál chrómového oxidu (III), predstavuje štruktúru uvedenú nižšie:
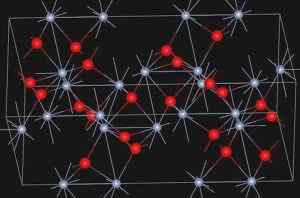 Kryštalická štruktúra minerálu Eskolaíta. https: // nahrávanie.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.Jpg. Zdroj: Wikipedia Commons
Kryštalická štruktúra minerálu Eskolaíta. https: // nahrávanie.Wikimedia.org/wikipedia/commons/e/ee/eskolaite_structure.Jpg. Zdroj: Wikipedia Commons Menovanie
- Oxid chróm (III).
- Oxid zeleného chrómu.
- Oxid dichroma.
- Chrómový oxid.
- Chróm.
- Eskolaíta: minerál oxidu chrómu (III).
- Hydrát: Cr2Ani3.NH2Alebo (kde sa N ≅ 2 nazýva hydrát chrómového oxidu (III) alebo Guignet Green.
 Hydrát chrómového oxidu (III). W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons
Hydrát chrómového oxidu (III). W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikipedia Commons Vlastnosti
Fyzický stav
Kryštalický tuhý.
Mohs tvrdosť
9 (ich kryštály sú mimoriadne ťažké).
Molekulová hmotnosť
151,99 g/mol.
Môže vám slúžiť: kvartérne zlúčeniny: Charakteristiky, školenie, príkladyBod topenia
Roztavuje sa pri 2435 ° C, ale začína sa odparovať na 2000 ° C, ktoré tvoria oblaky zeleného dymu.
Hustota
5,22 g/cm3
Rozpustnosť
Ak sa zahrieva pri vysokých teplotách, je prakticky nerozpustná vo vode (3 mikrogramov/l pri 20 ° C); nerozpustné v alkoholoch a acetóne; mierne rozpustné v kyselinách a alkaloch; SSOLUBLE kyselina z chlorista (HCLO4) na 70%, v ktorom sa rozkladá.
pH
6.
Index lomu
2 551.
Ďalšie vlastnosti
- Ak je silne kalcinovaný, stáva sa inertným smerom k kyselinám a základni. Inak cr2Ani3 a jeho hydratovaná forma cr2Ani3.NH2O Sú amfoterické, ľahko sa rozpúšťajú v kyseline, aby poskytli aqua -ions [cr (h (h2Buď)6]3+, a v koncentrovaných alkalich za vzniku „chromitos“.
- Keď bol kalcinovaný, je chemicky odolný voči kyselinám, alkáliám a vysokým teplotám. Je to mimoriadne stabilné2.
- Má vynikajúcu odolnosť voči svetlu, pretože jeho kryštály majú nepriehľadnosť, vysoké útlm a priehľadnosť voči viditeľnému svetlu.
- Je to mimoriadne tvrdý materiál, môžete poškriabať kremeň, tapacio a zirkonio.
- Jeho hydrát cr2Ani3.NH2Alebo (kde n ≅ 2) nemá tepelnú stabilitu, jej hydratačná voda obmedzuje jeho uplatniteľnosť na menej ako 260 ° C. Predstavuje nízku kapacitu farbenia a obmedzenú nuanciu nuancií.
- Ale tento hydrát má veľmi čistý a jasne zelený modrý odtieň. Je polotransparentný, predstavuje nízku nepriehľadnosť, vynikajúcu odolnosť voči svetlu a odolnosť voči alkálii.
- CR2Ani3 Nie je klasifikovaný ako nebezpečný materiál a považuje sa za inertný jemný prášok. Nepodliehajú medzinárodným predpisom o doprave.
- Neznepokojuje pokožku alebo sliznice.
Žiadosti
V keramickom a sklenenom priemysle
Vďaka svojej vysokej odolnosti voči tepla a chemickému odporu, CR2Ani3 Kalcinácia sa používa ako sfarbenie sfarbenia alebo pigmentu v keramike v porcelánových smaltkách a zmesi pre sklo.
V priemyselných povlakoch
Keramika s chrómovým oxidom (III) poskytuje vynikajúcu odolnosť proti väčšine korozívnych prostredí. To všetko prostredníctvom mechanizmu vylúčenia okolitého substrátu.
Z tohto dôvodu sa používa v povlakoch, aby sa zabránilo korózii mnohých materiálov, ktoré sa aplikujú tepelným sprejom (atomizácia alebo horúcej rosy).
Môže vám slúžiť: Chemický proces: princípy, typy, príkladyPoužíva sa tiež ako ochrana pred abrazívnym opotrebením (keď je odstránenie materiálu spôsobené časticami, ktoré sa pohybujú povrchom).
V týchto prípadoch uplatňovanie povlaku CR2Ani3 Ukladaním plazmou vytvára vysoký odpor oderu.
Predchádzajúce dva prípady majú užitočnosť napríklad v motoroch plynových turospaciálnych turbín.
V žiaruvzdornom priemysle
Používa sa v tepelnom a chemicky odolnom tehlách, poťahovacích materiáloch a refraktérnom betóne založenom.
Výstavba
Pretože je mimoriadne odolný voči atmosférickým podmienkam, svetlu a tepla, nanáša sa ako granulované farbivo na horniny pre asfaltové strechy, betónový cement, vysoko kvalitné priemyselné povlaky na exteriér, oceľové konštrukcie a fasáje (emulzné farby).
Ako pigment v rôznych aplikáciách
Môže podporovať podmienky vulkanizácie a neznižuje sa, takže sa používa pri gumovej pigmentácii.
Pretože sú netechnické, používa sa ako pigment pre hračky, kozmetiku (najmä jej hydrát), plasty, tlačiarenské atramenty, maľby, ktoré prichádzajú do styku s potravinami a farmaceutickými výrobkami.
V pigmentovom priemysle sa používa ako surovina na výrobu prenikajúcich farbív, ktoré obsahujú chróm a pigmenty založené na fázach zmiešaných oxidov kovov. Používa sa tiež ako sfarbenie obrazov na náter cievok.
Jeho hydrát má priehľadnosť, ktorá umožňuje formuláciu polychromatických povrchových úprav v automobilovom priemysle (povrchové úpravy kovových automobilov).
Vďaka svojej jedinečnej charakteristike odrážania infračerveného žiarenia (IR) podobné chlorofylu rastlín, pod infračerveným svetlom sa zdá, že lístie. Z tohto dôvodu je jeho použitie v maskovacích obrazoch alebo povlakoch pre vojenské aplikácie veľmi rozšírené.
Šperky
Používa sa ako farbivo syntetických drahokamov. Keď je CR zavedený2Ani3 ako nečistota v kryštalickej sieti a-al2Ani3, Rovnako ako v semi-rubínovom minerále, farba je červená namiesto zelenej.
Používa sa tiež ako mletie a leštené pre vysokú tvrdosť a drsné vlastnosti.
Na chemické reakcie
Podporené v hliníku (do2Ani3) alebo iné oxidy, sa používa v organickej chémii ako katalyzátor, napríklad v hydrogenácii esterov alebo aldehydov na tvorbu alkoholov a v uhľovodíkovej cyklizácii. Katalyzuje reakciu dusíka (n2) s vodíkom (h2) Na vytvorenie amoniaku (NH3).
Môže vám slúžiť: lítium: História, štruktúra, vlastnosti, riziká a použitiePre svoju kapacitu redukcie oxidu pôsobiacej spolu s oxidom chrómu (VI) hrá dôležitú úlohu pri dehydrogenácii alkánov2 Na výrobu propeno a izobuténu, pretože cyklus reaktivácie katalyzátora je ľahko spustiteľný. Používa sa tiež ako katalyzátor v anorganickej chémii.
V chrómovej výrobe
Používa sa v čistej chrómovej kovovej aluminotermálnej produkcii. Aby sa to dosiahlo, musí sa zahriať na 1 000 ° C, aby sa zvýšila veľkosť zrna.
 Príprava chrómových kovov hlinitou redukciou oxidu chrómu (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons
Príprava chrómových kovov hlinitou redukciou oxidu chrómu (III). Rando Tuikene [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikipedia Commons V magnetických materiáloch
Do magnetických materiálov zvukových a video pásky sa pridal do malých množstiev tým, že naučil samoimpresívny efekt zvuku hlavy.
Nedávne inovácie
Získali sa pigmenty, ktoré zlepšili odrazivosť v blízkosti nanočastíc Dopar Cr2Ani3 so soľami prvkov patriacich do skupiny vzácnych zemín, ako je Lantano a Praseodimio.
Zvýšenie koncentrácie týchto prvkov, slnečná odrazivosť blízkeho infračerveného zväzku bez ovplyvnenia zelenej farby CR ošípaných2Ani3.
To umožňuje klasifikovať CR2Ani3 doping ako „studený“ pigment, pretože je vhodný na kontrolu akumulácie tepla.
Aplikované na stropy, autá a čalúnenie, okrem iného, dosahuje vysokú odrazivosť slnečného žiarenia IR, čo nám umožňuje výrazne znížiť zvýšenie tepla v prostrediach.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 19. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Zväzok A7 a A20. VCH Verlagsgellschaft MBH.
- Americké prvky. (2019). Oxid chrómu (III). Zotavené z americalmentov.com.
- Lekárska knižnica. (2019). Oxid chrómu (III). Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Dorfman, Mitchell R. (2012). Tepelné povlaky. V príručke degradácie environmentálnych materiálov. Kapitola 19. Zotavené z vedeckých pracovníkov.com.
- Takehira, K. a kol. (2004). Co2 Dehydrogenácia propánu cez katalyzátor CR-MCM-41. V štúdiách v oblasti povrchovej vedy a katalýzy 153. Zotavené z vedeckých pracovníkov.com.
- Selvam Sangeetha a kol. (2012). Funkčné pigmenty z oxidu nanočastíc chrómu (III). Farbivá a pigmenty 94 (2012) 548-552. Zotavené z vedeckých pracovníkov.com.

