Oxid vápenatý (CAO)
- 3796
- 646
- Ing. Ervín Petruška
Čo je oxid vápenatý?
On oxid vápenatý (CAO) je anorganická zlúčenina, ktorá obsahuje vápnik a kyslík v iónových formách (aby sa nezamieňal s peroxidom vápenatého, CAO2). Svetový známy ako vápno, slovo, ktoré označuje každú anorganickú zlúčeninu, ktorá obsahuje uhličitany, oxidy a hydroxidy vápenatého, okrem iných kovov, ako sú kremík, hliník a železo.
K tomuto oxidu (alebo vápna) tiež hovoria hovorovo ako živé alebo vápno, v závislosti od toho, či je hydratovaný alebo nie. Živo vápno je oxid vápenatý, zatiaľ čo vápno je jeho hydroxid. Na druhej strane je vápenec (vápno alebo tvrdené vápno) v skutočnosti sedimentárna hornina zložená hlavne z uhličitanu vápenatého (Caco3).
Je to jeden z najväčších prírodných zdrojov vápnika a predstavuje surovinu na výrobu oxidu vápenatého. Ako sa vyrába tento oxid? Uhličitany sú náchylné na tepelný rozklad; Zahrievanie uhličitanov vápenatého pri teplotách vyšších ako 825 ° C vedie k tvorbe vápna a oxidu uhličitého.
Predchádzajúce vyhlásenie možno opísať takto: Caco3(s) → CAO (s) + co2g). Pretože zemská kôra je bohatá na vápenec a kalcit a v oceánoch a plážach sú morské škrupiny (suroviny na výrobu oxidu vápenatého) hojné, oxid vápenatý relatívne lacný činidlo.
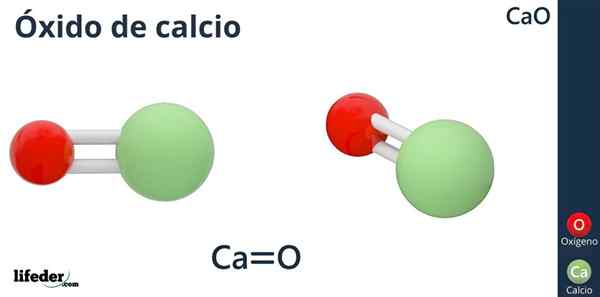
Vzorec
Chemický vzorec oxidu vápenatého je CAO, v ktorom je vápnik ako kyslý ión (akceptor elektrónov) CA2+, a kyslík, ako je základný ión (darca elektrónov) alebo2--.
Prečo má vápnik náboj +2? Pretože vápnik patrí do skupiny 2 periodickej tabuľky (SR. Scholambara) a má iba dva valenčné elektróny na tvorbu odkazov, ktoré vedú k atómu kyslíka.
Môže vám slúžiť: oxid draselný (K2O)Štruktúra oxidu vápenatého
 Kryštalická štruktúra oxidu vápenatého
Kryštalická štruktúra oxidu vápenatého Kryštalická štruktúra (typ soli drahokamu) pre oxid vápenatý je znázornený na hornom obrázku. Objemné červené gule zodpovedajú iónom CA2+ a biele gule ión alebo2-.
V tomto kubickom kryštalickom usporiadaní každý ión ca2+ je obklopený šiestimi iónmi alebo2-, Oklfikované v oktaedrických dierach, ktoré medzi nimi zanechali veľké ióny.
Táto štruktúra vyjadruje maximálny iónový charakter tohto oxidu, hoci pozoruhodný rozdiel rádií (červená guľa je väčšia ako biela) jej dodáva slabšiu kryštalickú retikulárnu energiu v porovnaní s MGO.
Vlastnosti oxidu vápenatého
 Vzhľad oxidu vápenatého
Vzhľad oxidu vápenatého Fyzicky je to kryštalická biela tuhá látka, toaleta a so silnými elektrostatickými interakciami, ktoré sú zodpovedné za ich vysoké zlúčené body (2572 ° C) a varenie (2850 ° C). Okrem toho má molekulovú hmotnosť 55 958 g/mol a zaujímavú vlastnosť termoluminiscencie.
To znamená, že kúsok oxidu vápenatého vystaveného plameňu môže žiariť intenzívnym bielym svetlom, známym v angličtine s menom Neúctivosť, alebo v španielčine, vápnikové svetlo. Ióny CA2+, V kontakte s ohňom vznikajú červenkastým plameňom, ako je vidieť na nasledujúcom obrázku.
 Vápnikové svetlo alebo centra pozornosti
Vápnikové svetlo alebo centra pozornosti Rozpustnosť
CAO je základný oxid, ktorý má silnú afinitu k vode, do tej miery, že absorbuje vlhkosť (je to hygroskopická tuhá látka), ktorá okamžite reaguje na vypnutie alebo hydroxid vápenatý:
CAO (s) + h2Alebo (l) => ca (OH)2(S)
Táto reakcia je exotermická (vzdáva sa tepla) v dôsledku tvorby tuhej látky so silnejšími interakciami a stabilnejšou kryštalickou sieťou. Reakcia je však reverzibilná, ak sa Ca (OH) zahrieva2, dehydratácia a osvetlenie vápna; Potom vápno „znovuzrodený“.
Môže vám slúžiť: Safranine: Charakteristiky, použitie, techniky, toxicitaVýsledný roztok je veľmi základný a ak je nasýtený oxidom vápenatého, dosahuje pH 12,8.
Podobne je rozpustný v glycerolu a v kyslých a sladkých roztokoch. Rovnako ako základný oxid, má prirodzene účinné interakcie s oxidmi kyselín (SIO2, Do2Ani3 A viera2Ani3, napríklad) sú rozpustné v ich kvapalných fázach. Na druhej strane je nerozpustný v organických alkoholoch a rozpúšťadlách.
Použitie/aplikácie
CAO má obrovské nespočetné priemyselné použitie, ako aj v syntéze acetylénu (CH≡CH), pri extrakcii fosforečnanov odpadových vôd a pri reakcii s oxidom nealkoholických nápojov s siričivým nápojom.
Ďalšie použitia oxidu vápenatého sú opísané nižšie:
Ako malta
Ak je oxid vápenatý zmiešaný s pieskom (SIO2) a voda, koláče s pieskom a pomaly reaguje s vodou za vzniku matného vápna. Zase, CO2 Z vzduchu sa rozpustí vo vode a reaguje so soľou, aby vytvoril uhličitan vápenatý:
CA (OH)2(s) + co2(g) => Caco3(s) + h2Alebo (l)
Caco3 Je to odolnejšia a tvrdšia zlúčenina ako CAO, čo spôsobuje, že malta (predchádzajúca zmes) stvrdne a fixuje tehly, bloky alebo keramiku medzi nimi alebo na požadovaný povrch.
V produkcii skla
Základnou surovinou na výrobu skla sú oxidy kremíka, ktoré sa zmieša s vápnom, uhličitanom sodným (NA2Co3) a ďalšie prísady a potom sa podrobené otepľovaniu, čo vedie k sklovitej pevnej láske. Táto tuhá látka je následne zahrievaná a fúkaná v akýchkoľvek číslach.
Ťažba
Malé vápno zaberá väčší objem ako živé vápno v dôsledku interakcií vodíkovým mostom (O-H-O). Táto vlastnosť sa využíva na prelomenie skaly od svojich Deems.
Môže vám slúžiť: katalytická hydrogenáciaTo sa dosiahne naplnením kompaktným zmesi vápna a vody, ktorá je utesnená, aby sa zaostrila jeho teplo a rozsiahla energia v skale.
Ako remover kremičitý
CAO sa spája s kremičitanumi za vzniku koalescentnej kvapaliny, ktorá sa potom extrahuje zo suroviny zo suroviny zo určitého produktu.
Napríklad minerály železa sú surovinou na výrobu kovového železa a ocele. Tieto minerály obsahujú kremičitany, ktoré sú pre tento proces nežiaduce nečistoty a sú eliminované nedávno opísanou metódou.
Nanočastice oxidu vápenatého
Oxid vápenatý sa môže syntetizovať ako nanočastice, meniť sa koncentrácie dusičnanu vápenatého (CA (NO3)2) a hydroxid sodný (NaOH) v roztoku.
Tieto častice sú sférické, základné (ako aj tuhé až makro stupnice) a majú veľa povrchovej plochy. V dôsledku toho tieto vlastnosti prospievajú katalytickým procesom. Aký? Vyšetrovania v súčasnosti na túto otázku odpovedajú.
Tieto nanočastice sa používajú na syntézu substituovaných organických zlúčenín - ako sú odvodené od pyridínu - pri formulácii nových liekov na vykonávanie chemických transformácií, ako je umelá fotosyntéza, na čistenie vody z ťažkých a škodlivých kovov a ako fotokatalytické činidlá.
Nanočastice sa dajú syntetizovať na biologickú podporu, ako sú papája a listy zeleného čaju, aby sa ich použili ako antibakteriálne činidlo.
Odkazy
- Scifun.orgán. (2018). Vápno: oxid vápenatý. Získané z: Scifun.orgán.
- Wikipedia. (2018). Oxid vápenatý. Zdroj: In.Wikipedia.orgán
- Publikácia. (2018). Oxid vápenatý. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Triasť a Atkins. (2008). Anorganická chémia. V Prvky skupiny 2. (Štvrté vydanie., p. 280). MC Graw Hill.