Oxid bóru (B2O3) Čo je, štruktúra, vlastnosti, používa
- 4958
- 924
- Alfréd Blaho
On oxid bóru o borická anhydrid je anorganická zlúčenina, ktorej chemický vzorec je b2Ani3. Rozdiel v elektronegativite medzi nimi nie je príliš vysoký; Preto sa očakáva, že B2Ani3 mať kovalentnú povahu.
B2Ani3 Pripravuje sa rozpustením boraxu v koncentrovanej kyseline sírovej vo vnútri zlúčenej pece a pri teplote 750 ° C; Tepelne dehydratačná kyselina boritá, B (OH)3, pri teplote približne 300 ° C; alebo sa môže tiež tvoriť ako produkt diboránovej reakcie (b2H6) S kyslíkom.
Oxid boro môže mať polotransparentný alebo kryštalický sklenený vzhľad; Posledne menované brúsením sa dá získať v prachovej forme.
Aj keď sa to nezdá byť prvý pohľad, B sa považuje za2Ani3 ako jeden z najkomplexnejších anorganických oxidov; Nielen zo štrukturálneho hľadiska, ale aj z dôvodu premenlivých vlastností, ktoré sklo a keramika získavajú, ku ktorým sú pridané do svojej matrice.
Štruktúra oxidu boro
Jednota bo3
B2Ani3 Je to kovalentná pevná látka, takže teoreticky neexistujú vo svojej štruktúre iónov B3+ ani2-, Ale odkazy B-O. Bór, podľa Valenciaho teórie spojenia (TEV), môže tvoriť iba tri kovalentné spojenia; V tomto prípade tri odkazy B-O. V dôsledku toho musí byť očakávaná geometria trigonálna, bo3.
Molekula Bo3 Sú to zlé elektróny, najmä atómy kyslíka; Niektorí z nich však môžu navzájom interagovať, aby dodali uvedený nedostatok. Takto, trojuholníky bo3 Pripojte sa k zdieľaniu kyslíkového mosta a sú distribuované vo vesmíre ako trojuholníkové riadky siete s ich lietadlami orientovanými rôznymi spôsobmi.
Môže vám slúžiť: Nenasýtené riešenieKryštalická štruktúra
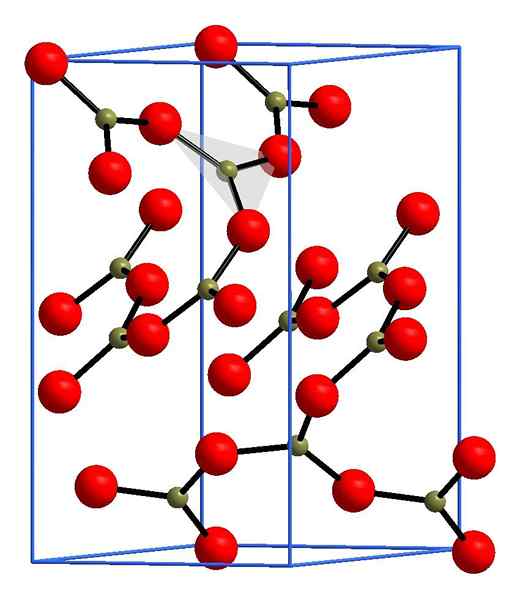
 Štruktúra oxidu boro. Andif1, Wikimedia Commons.
Štruktúra oxidu boro. Andif1, Wikimedia Commons. Na hornom obrázku je príklad týchto riadkov s trojuholníkovými jednotkami bo3. Ak sa pozorne pozoruje, nie všetky tváre plánov poukazujú na čitateľa, ale na druhú stranu. Orientácie týchto tvárí môžu byť zodpovedné za to, ako sa definuje B2Ani3 pri určitej teplote a tlaku.
Ak majú tieto siete štrukturálny vzorec s dlhým rozsahom, je to kryštalická tuhá látka, ktorá môže byť vytvorená z jej jednotkovej bunky. Tu sa hovorí, že B2Ani3 Má dva kryštalické polymorfy: a a p.
A-B2Ani3 Vytvára sa v okolitom tlaku (1 atm) a hovorí sa, že je kineticky nestabilný; V skutočnosti je to jeden z dôvodov, prečo je oxid bóry pravdepodobne zložitou kryštalizáciou.
Druhý polymorf, p-B2Ani3, Vysoké tlaky sa získavajú v rozsahu GPA; Preto musí byť jeho hustota väčšia ako hustota a-B2Ani3.
Sklovitá štruktúra
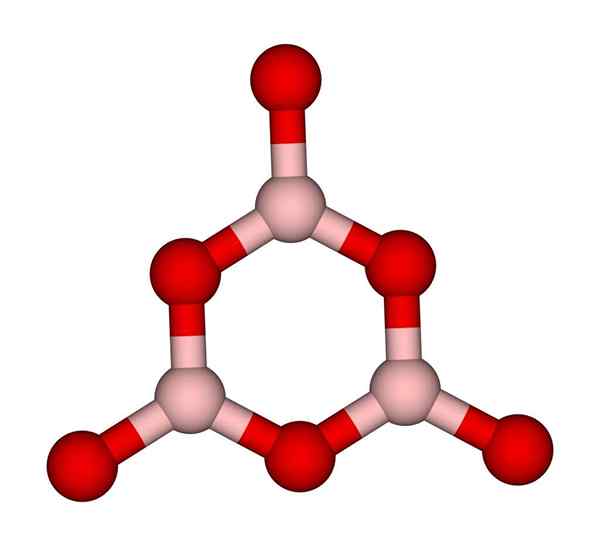 Boroxolový prsteň. CCOIL (Talk). Wikimedia Commons.
Boroxolový prsteň. CCOIL (Talk). Wikimedia Commons. Siete BO3 Prirodzene majú tendenciu prijímať amorfné štruktúry; To sú, ktoré nemajú vzor, ktorý popisuje molekuly alebo ióny v tuhej látka. Syntetizáciou B2Ani3 Jeho prevládajúca forma je amorfná a nie kryštalická; Správnymi slovami: Je to pevné sklovité ako kryštalické.
Potom sa hovorí, že B2Ani3 Je sklovitý alebo amorfný, keď vaši chlapci z Bo3 Sú chaotickí. Nielen to, ale tiež meniť spôsob, akým sa pripoja. Namiesto objednávania v trigonálnej geometrii končí boroxolový krúžok (vynikajúci obraz), aby vytvoril vedcov (vynikajúci obraz).
Môže vám slúžiť: 20 príkladov chemickej energieVšimnite si zjavný rozdiel medzi trojuholníkovými a šesťuholníkovými jednotkami. Trojuholníková charakterizácia B2Ani3 kryštalické a hexagonálne k B2Ani3 sklovitý. Ďalším spôsobom, ako sa odvolávať na túto amorfnú fázu, je sklo bóru alebo pomocou vzorca: G-B2Ani3 („G“ pochádza zo slova sklovitý, v angličtine).
Siete G-B tak2Ani3 Skladajú sa z boroxolových krúžkov a nie jednotiek BO3. G-B však2Ani3 môže kryštalizovať na a-B2Ani3, čo by znamenalo vzájomnú vzájomnú konverziu kruhov do trojuholníkov a tiež definoval stupeň dosiahnutej kryštalizácie.
Vlastnosti
Fyzický vzhľad
Je to bezfarebná a sklovitá pevná látka. Vo svojej kryštalickej forme je biela.
Molekulárna hmotnosť
69 6182 g/mol.
Príchuť
Mierne horký
Hustota
-Kryštalické: 2,46 g/ml.
-Sklovím: 1,80 g/ml.
Bod topenia
Nemá plne definovaný bod fúzie, pretože záleží na tom, aký je kryštalický alebo sklovitý. Čisto kryštalická forma sa topí na 450 ° C; Sklovec sa však topí do teplotného rozsahu, ktorý pokrýva od 300 do 700 ° C.
Bod varu
Opäť platí, že uvedené hodnoty sa nezhodujú s touto hodnotou. Zjavne oxid tekutiny bóru (roztavený z jeho kryštálov alebo skla) Varí sa pri 1860 ° C.
Stabilita
Musí sa udržiavať v suchu, pretože absorbuje vlhkosť, aby sa transformovala na kyselinu boritú, B (OH)3.
Menovanie
Oxid boro môže byť pomenovaný inými spôsobmi, napríklad:
-DiBoro Trioxid (systematická nomenklatúra).
-Oxid bóry (III) (nomenklatúra zásob).
-Oxid borice (tradičná nomenklatúra).
Žiadosti
Niektoré z použití oxidu bóru sú:
Syntéza Boro Trihalogenuros
Z B2Ani3 môže byť syntetizovaný Trihagenuros de Boro, BX3 (X = f, cl y br). Tieto zlúčeniny sú Lewis kyseliny a spolu s nimi je možné zaviesť atómy bóru do určitých molekúl, aby sa získali ďalšie deriváty s novými vlastnosťami.
Môže vám slúžiť: polyiatomické ióny: zoznam a cvičeniaInsekticíd
Pevná zmes s kyselinou boritá, b2Ani3-B (oh)3, predstavuje vzorec, ktorý sa používa ako domáci insekticíd.
Rozpúšťadlo oxidov kovov: Tvorba skla, keramika a zliatiny bóru
Kvapalný oxid bóru je schopný rozpúšťať oxidy kovov. Z tejto výslednej zmesi, akonáhle sa ochladí, sa získajú tuhé látky zložené z bóru a kovov.
V závislosti od množstva B2Ani3 Používa sa, ako aj technika a typ kovového oxidu, bohatej škály skla (borosilikáty), keramiky (nitridy a bórové karbidy) a zliatiny sa dajú získať (ak sa používajú iba kovy).
Všeobecne platí, že sklo alebo keramika získava väčší odpor a pevnosť a tiež väčšiu trvanlivosť. V prípade skla sa nakoniec používajú na optické a ďalekohľadové šošovky a pre elektronické zariadenia.
Spojivo
Pri výstavbe oceľových zlieva rúry sa používajú refraktérne tehly s horčíkom. V nich sa oxid bóru používa ako spojivo, čo pomáha udržiavať si silne zjednotenú.
Odkazy
- Oxid boriky. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Oxid borix. 20 Mule Team Borax. Získané z: Borax.com

