Oxid síry
- 1269
- 276
- Ing. Ervín Petruška
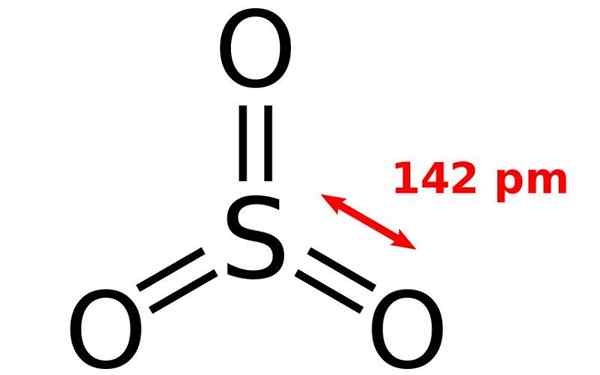
 Chemická štruktúra molekuly oxidu síry. Zdroj: Joel Holdsworth, Wikimedia Commons
Chemická štruktúra molekuly oxidu síry. Zdroj: Joel Holdsworth, Wikimedia Commons Čo je oxid síry?
On oxid síry (Vi), tiež známy ako síra alebo trikxid anhydridu sírou, je chemická zlúčenina vzorcov3, Že za normálnych podmienok je to bezfarebná a vláknitá pevná látka a pri 25 ° C a 1 atm je silným znečisťujúcim činidlom, zodpovedným za kyslý dážď.
Oxid siričitý sa produkuje oxidáciou oxidu síry.
Až doteraz však jediný čistý prípravok oxidu siričitého z plynov obsahujúcich plyny obsahujúci3 zriedený, bol to proces na stupnici pilotov, ktorý znamená kryoskopickú kondenzáciu.
Zvyčajný postup namiesto toho znamená destiláciu ropy. Teplo potrebné pre destiláciu oleja je dodávané pohodlnejšie pomocou horúceho kontaktného plynu z pridruženej rastliny kyseliny sírovej.
Môže sa pripraviť v laboratóriu zahrievaním kyseliny sírovej fajčiarovej a zberom sublimovaných v ochladzovanom prijímači. Ak sa para kondenzuje nad 27 ° C, tvar gama sa získa ako kvapalina.
Ak sa para kondenzuje pod 27 ° C a v prítomnosti vlhkosti, získa sa zmes troch foriem. 3 formy môžu byť oddelené frakčnou destiláciou.
Spaľovanie fosílneho paliva je príčinou jeho vzhľadu v atmosfére, čo je hlavnou antropogénnou príčinou.
Fyzikálne a chemické vlastnosti oxidu síry
- Oxid sír. Často sa stretávate s inhibítormi, aby ste sa vyhli polymerizácii.
Môže vám slúžiť: Renio: Discovery, vlastnosti, štruktúra, použitie- Jeho molekulová hmotnosť je 80 066 g/mol, jej hustota je 1,92 g/cm³ g/ml a body fúzie a varu sú 16,8 ° C a 44,7 ° C, respektíve 44,7 ° C, respektíve.
- Zlúčenina je kombinovaná s vodou s výbušnou silou, ktorá tvorí kyselinu sírovú kvôli jej kyslosti. Organické látky oxidu karboniza.
- Trioxid síry rýchlo absorbuje vlhkosť a emituje husté biele výpary. Roztoky trioxidu kyseliny sírovej sa nazývajú fajčenie kyseliny sírovej alebo olej.
- Reakcia oxidu siričitého a kyslíkový difluorid je veľmi energický a výbuchy sa vyvolávajú, ak sa reakcia vykonáva v neprítomnosti rozpúšťadla.
- Prebytočná reakcia oxidu siričitého s tetrafluóretylénom spôsobuje výbušný rozklad karbonylového fluoridu a oxidu siričitého.
- Reakcia kyseliny bezvodej kyseliny chlorista so siričitým oxidom je násilná a je sprevádzaná vývojom značného tepla. Kvapalný siričitý oxid násilne reaguje s nitrilovým chloridom, dokonca 75 ° C.
- Reakcia oxidu siričitého a oxid olova spôsobuje bielu luminiscenciu. Kombinácia jódu, pyridínu, síry a trikamidu formamidu vyvinula plyn po tlaku po niekoľkých mesiacoch.
Dôvodom je pomalá tvorba kyseliny sírovej, vonkajšej vody alebo dehydratácie kyanidu kyanidu vodíka.
Riziká
TRIOXID SRUFUR je stabilná zlúčenina, nezlučiteľná s organickými materiálmi, jemne práškovými kovmi, základňami, vodou, kyanidmi a širokou škálou ďalších chemikálií.
Látka je silným oxidantom a násilne reaguje s horľavými materiálmi a organizátormi a organickými zlúčeninami, ktoré spôsobujú oheň a nebezpečenstvo výbuchu.
Môže vám slúžiť: oxalát sodný (Na2C2O4): Štruktúra, vlastnosti, použitia, rizikáNásilne reaguje s vlhkou vodou a vzduchom, čím sa produkuje kyselina sírová. Roztok vo vode je silná kyselina, násilne reaguje so základňami a korozívnymi kovmi a vytvára horľavý / výbušný plyn.
Zlúčenina je korozívna pre kovy a tkanivá. Spôsobuje popáleniny v očiach a pokožke. Požitie spôsobuje silné popáleniny v ústach, pažeráku a žalúdku. Para je inhaláciou veľmi toxická.
V prípade kontaktu s očami musíte overiť, či sa používajú kontaktné šošovky, a okamžite ich odstráňte. Oči by mali byť opláchnuté tečúcou vodou najmenej 15 minút, pričom viečka sú otvorené. Môže sa použiť studená voda, bez nanášania očnej masy.
Ak chemikália príde do styku s oblečením, zachovajte ju čo najrýchlejšie a chráňte svoje vlastné ruky a telo. Položte obeť pod bezpečnostnú sprchu.
Ak sa chemická látka hromadí v exponovanej pokožke obete, ako sú ruky, pokožka kontaminovaná tečúcou vodou a neabrazzívne mydlo je jemne umyté a opatrne. Môže sa použiť studená voda. Ak podráždenie pretrváva, vyhľadajte lekársku pomoc. Pred opätovným použitím umyte kontaminované oblečenie.
V prípade vdýchnutia by sa obeť mala nechať stáť v dobre vetranej oblasti. Ak je inhalácia vážna, obeť sa musí čo najskôr evakuovať do bezpečnej oblasti. Voľné pevné oblečenie, ako je krk košele, opasky alebo kravata.
Ak je obeť ťažké dýchať, musí sa podávať kyslík. Ak obeť nedýcha, urobí sa resuscitácia úst v ústach. Vždy berúc do úvahy, že to môže byť nebezpečné pre osobu, ktorá poskytuje pomoc pri poskytovaní resuscitácie úst, keď je vdýchnutý materiál toxický, infekčný alebo korozívny.
Môže vám slúžiť: kyselina hypofyzárna (H3PO2): Vlastnosti, použitie a činidláVo všetkých prípadoch by sa mala hľadať okamžitá lekárska starostlivosť.
Na druhej strane, znečistenie ovzdušia v dôsledku oxidov síry je dôležitým problémom s životným prostredím, s miliónmi ton oxidu siričitého a trioxidu emitovanými do atmosféry každý rok emitovaný do atmosféry. Tieto zlúčeniny sú škodlivé pre rast rastlín a zvierat, ako aj pre mnoho stavebných materiálov.
Ďalším veľkým problémom, ktorý treba zvážiť, je kyslý dážď. Oxidy síry sa rozpúšťajú v atmosférickej vode, aby tvorili kyslé roztoky, ktoré môžu byť veľmi škodlivé, keď padajú vo forme dažďa.
Kyslý dážď môže poškodiť lesy a spôsobiť zomrieť ryby v mnohých jazerách. Je tiež korozívny pre kovy, vápenec a iné materiály. Možné riešenia tohto problému sú drahé kvôli ťažkostiam odstránenia síry uhlia a ropy pred spálením.
Žiadosti
- Oxid siričitý je základným činidlom v sulfonačných reakciách. Tieto procesy poskytujú detergenty, farbivá a farmaceutické výrobky. Generuje sa in situ z kyseliny sírovej alebo sa používa ako roztok kyseliny sírovej.
- Jeho dezinfekčné vlastnosti sú zodpovedné za storočia, aby sa mohli použiť na dezinfekciu kociek vín, spaľovanie síry vo vnútri.
Odkazy
- Oxidová síra. Zotavené z EBI.Ac.Uk
- BEZPEČNOSŤ TRIOXID SIRURFUR. Zotavený zo scienceLab.com

