Tiosíran sodný (Na2S2O3)

- 2965
- 859
- JUDr. Rudolf Čapkovič
 Tiosíran sodný sodný soli. S licenciou
Tiosíran sodný sodný soli. S licenciou Čo je tiosíran sodný?
On tiosulfát sodný alebo hyposulfit sodný (NA2Siež2Ani3) Je to dôležitá anorganická soľ s niekoľkými lekárskymi použitiami. Je tiež k dispozícii ako vaša pentahydrátová soľ (NA2Siež2Ani3.5H2Buď).
Je to iónová zlúčenina tvorená dvoma katiónmi sodíka (NA+) a negatívne načítaný tiosulfát (s2Ani3-), v ktorom je centrálny atóm síry spojený s tromi atómami kyslíka a ďalším atómom síry (odtiaľ predpony -tio), prostredníctvom jednoduchých a dvojitých väzieb s rezonančným znakom. Tuhá látka existuje v monoklinickej kryštalickej štruktúre.
Tiosíran sodný môže pripraviť zahrieňovú síru s vodným roztokom sulfit sodným alebo vodným roztokom hydroxidu sodného.
6naoh + 4s → NA2Siež2Ani3 + Druhý2S + 3H2Ani
Toto je liek, ktorý je na zozname základných liekov Svetovej zdravotníckej organizácie, najúčinnejších a najbezpečnejších liekov, ktoré sú potrebné v zdravotníckom systéme.
Fyzikálne a chemické vlastnosti
- Tiosíran sodný má molekulovú hmotnosť 158,11 g/mol pre bezvodý tvar a 248,18 g/mol pre tvar pentahydrátu.
- Predstavuje hustotu 1 667 g/ml.
- Tiosíran sodný je bezfarebný monoklinický kryštál bez charakteristickej arómy. Táto tuhá látka je výtvarná, čo znamená, že sa dá redukovať na prach samoou stratou kryštalizačnej vody, keď je vystavená vzduchu.
- Zlúčenina má bod topenia 48 ° C pre formy pentahydrátu a od 100 ° C sa začína rozkladať.
- Potom2Siež2Ani3 Je veľmi rozpustný vo vode a je schopný rozpustiť 70 gramov na 100 mililitrov rozpúšťadla. Zlúčenina je prakticky nerozpustná v etanole.
Môže vám slúžiť: absorpčné spektrum- Tiosíran sodný je neutrálna soľ, ktorá sa ľahko disociuje vo vode, čím sa poskytuje sodík a tiosíranské ióny. Nat2Siež2Ani3 Je to stabilná tuhá látka za normálnych podmienok, ale pri zahrievaní sa rozkladá, aby sa dal síran sodný a polysulfid sodný:
4NA2Siež2Ani3 → 3na2SW4 + Nat2Siež5
- Pri ošetrení zriedenými kyselinami sa tiež rozkladá, aby sa dal siriči a oxid siričitého (nazývaný hodinová reakcia):
Nat2Siež2Ani3 + 2HCl → 2NACL + S + SO2 + H₂o
- Stoichiometricky reaguje (v rovnomerných množstvách) s vodnými roztokmi jódu, takže sa široko používa v laboratóriách pre stupne jódov.
Reaktivita a nebezpečenstvo
Tiosíran sodný nie je toxický materiál a používa sa na lekárske účely. Avšak, keď sa rozkladá, produkuje toxické výpary oxidu síry, ktoré môžu spôsobiť podráždenie v očiach, koži a slizniciach.
Zlúčenina môže dráždiť oči, pokožku a dýchací trakt. Látka je toxická pre pľúca a sliznice. Opakované alebo predĺžené vystavenie látke môže spôsobiť poškodenie týchto orgánov.
Ak sa zlúčenina dostane do kontaktu s očami, kontaktné šošovky sa musia skontrolovať a odstrániť v prípade ich prepravy. Oči s veľkým množstvom vody by sa mali okamžite premyť najmenej 15 minút studenou vodou.
V prípade kontaktu s kožou musí byť postihnutá oblasť najmenej 15 minút prepláchnutá, zatiaľ čo kontaminované oblečenie a topánky sú odstránené.
Musíte pokryť pokožku podráždenú zmätevom. Predtým, ako ich znova použijete, umyte oblečenie a topánky. Ak je kontakt vážny, umyte sa dezinfekčným mydlom a zakryte pokožku kontaminovanú antibakteriálnym krémom.
Môže vám slúžiť: kyslík: vlastnosti, štruktúra, riziká, použitieV prípade vdýchnutia sa obeť musí preniesť na čerstvé miesto. Ak nedýchate, podáva sa umelé dýchanie. Ak je dýchanie ťažké, musí sa poskytnúť kyslík.
Ak sa zlúčenina požije, zvracanie by sa nemalo vyvolať, pokiaľ to zdravotnícky personál neuvádza. Uvoľnite tesné oblečenie, ako je krk košele, opasok alebo kravata.
Vo všetkých prípadoch je potrebné získať okamžitú lekársku starostlivosť.
Žiadosti
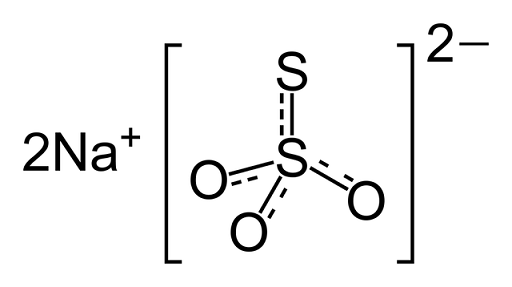 Chemická štruktúra tiosíranu sodného
Chemická štruktúra tiosíranu sodného Liek
- Tiosíran sodný sa môže použiť na zníženie niektorých vedľajších účinkov cisplatiny (rakovina).
- Používa sa na liečbu extravazácie počas chemoterapie. Tiosíran sodný zabraňuje alkylácii a deštrukcii tkaniva, ktorý poskytuje substrát pre prenajaté činidlá, ktorí napadli subkutánne tkanivá.
- Používa sa tiež s iným liekom pri núdzovej liečbe otravy kyanidom.
Pri tomto ošetrení sa dusitan sodný injikuje intravenózne, aby sa vytvoril hemoglobín, ktorý sa kombinuje s iónom kyanidu, dočasne ho mení na formu Cianemetoglobínu. Následne sa injikuje tiosulfát sodný.
- Slúži ako substrát pre enzým Rodanasa, ktorý katalyzuje konverziu kyanidu na oveľa menej toxický tiociant, ktorý sa vylučuje v moči.
- Používa sa tiež ako liečba kalcifilaxie u ľudí pri hemodialýze s terminálnym ochorením obličiek. Zdá sa, že neexistuje úplne pochopený jav, pričom to spôsobuje závažnú metabolickú acidózu u niektorých pacientov.
Jodometria
- Tiosíran sodný reaguje stechiometricky s jódom, čím sa jodid dáva podľa reakcie:
Môže vám slúžiť: Ketóny: typy, vlastnosti, nomenklatúra, použitia, príkladyDruhý2Siež2Ani3 + I2 → S4Ani62- + 2i-
Táto vlastnosť robí zlúčeninu použitú ako názov pri určovaní jódu.
- Toto konkrétne použitie je možné stanoviť na meranie obsahu kyslíka vo vode prostredníctvom dlhej série reakcií v Winklerovom teste na rozpustený kyslík.
- Používa sa tiež na objemový odhad koncentrácií určitých zlúčenín v roztoku (napríklad peroxid vodíka) a pri odhadovaní obsahu chlóru v komerčnom prášku bielidla a vody.
Voda
- Tiosíran sodný sa používa na zverejnenie vody vrátane zníženia hladín chlóru na použitie v akváriách a bazénoch a kúpeľoch a vo vnútri vodných úprav na úpravu zadnej umývacej vody založenej pred uvoľňovaním v riekach.
Redukčná reakcia je analogická reakcii redukcie jódu, tiosulfát redukuje hypochlorit (aktívna zložka v bielidle) a pritom oxiduje na síran sulfát. Úplná reakcia je:
4NACLO + NA2Siež2Ani3 + 2NAOH → 4NACL + 2NA2SW4 + H2Ani
Ťažba zlata
Tiosíran sodný je zložka, ktorá sa používa ako alternatívne vylúhovacie činidlo na kyanid na extrakciu zlata. Tvorí však silný rozpustný komplex so zlatými iónmi (i), [au (s2Ani3)2]3-.
Výhodou tohto prístupu je to, že tiosíran nie je v podstate toxický a že typy minerálov, ktoré sú refraktérne k kyanrácii zlata, môžu byť vylúhované tiosulfátom.
Odkazy
- HSDB: Tiosíran sodný. Zotavený z Toxnet.NLM.NIH.Vláda.
- Bezpečnostné údaje sodný Tiosírant bezvodého materiálu. Zotavený zo scienceLab.com.

