Tioles
- 1831
- 85
- Adrián Fajnor
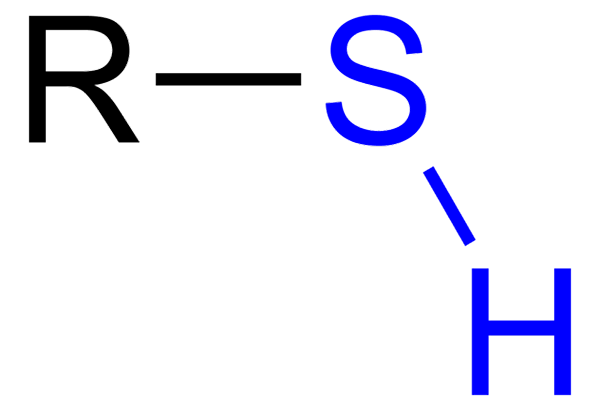
Ten Tioles Sú to organické zlúčeniny, ktoré majú skupinu SH, nazývanú skupina Tiol alebo Sulfihydrilo Group. Jeho všeobecný vzorec je RSH, ktorý je schopný zastupovať R pre nájomné, aryl alebo inú chemickú skupinu. Výraznou charakteristikou tiolov je jeho silná smradlá vôňa.
Niektoré tioly sa používajú na prepožičanie vône horľavých plynov, aby sa zistilo únik týchto plynov, ktoré vzhľadom na ich charakteristiku môžu mať veľké nebezpečenstvo. Tioles sú podobné alkoholom, pretože majú skupinu OH, zatiaľ čo tioles a sh.
 Tiol s modrou skupinou sulfhydrillo
Tiol s modrou skupinou sulfhydrillo Na druhej strane však majú niekoľko rozdielov: Skupina OH je viac polárna ako skupina SH a síra je menší atóm ako kyslík a menej elektronegatívne.
To určí, že molekuly tiol. Preto je rozpustnosť tiolov vo vode nízka a jeho bod varu je nižší ako v prípade alkoholov s reťazou podobných uhlíkov.
Tioles sú obzvlášť užitočné a časté v biochemických systémoch, pretože niekoľko zodpovedajú biomolekúl, ako je koenzým k. Jeho väzba S-H je kyslejšia ako O-H, ľahšie sa rozbije a ľahšie nahradí alebo nahradí ďalšie molekulárne fragmenty v mnohých organických syntézach síry.
[TOC]
Vlastnosti tiol
 Páchnuca aróma úpätia je zložená hlavne z tiol
Páchnuca aróma úpätia je zložená hlavne z tiol Všeobecná činnosť
Skupina OH alkoholov a skupina SH Tioles zdieľajú súbor fyzikálnych a chemických vlastností pre príslušnú kyslík a síru do tej istej chemickej skupiny periodickej tabuľky (prostredníctvom skupiny).
Loa Tioéters, Uniocetals a Tioésters, ktoré sú analogické chemickým zlúčeninám tvoreným alkoholom, ako sú étery, acetály a estery. Odkazy S-H a O-H však predstavujú určité rozdiely, ktoré sa odrazia v vlastnostiach tiolov a alkoholov.
Vôňa
Charakteristiou tiolov s nízkou molekulovou hmotnosťou je jej nepríjemná vôňa, podobná cesnaku a cibule. Táto vôňa je taká veľkosť, že ľudská vôňa má prah jednej časti tiolu pre desať miliárd častí vzduchu.
Etanotiol sa pridáva do zemného plynu ako bezpečnostné opatrenie, aby sa zistilo, že samotný horľavá, ale sama unikne toalety. Vôňa tiolov klesá zvýšením počtu uhlíkov ich reťazca, pretože volatilita a podiel tiolovej síry klesá.
Môže vám slúžiť: fosforečnan amónny: štruktúra, vlastnosti, získanie, použitiaBod varu a rozpustnosť
S-H spojenie tiolov má dipólový moment menej ako O-H spojenie alkoholov. Atóm síry je navyše menší a menší elektronegativita ako atóm kyslíka.
To určuje, že molekuly tiolov nemôžu tvoriť vodíkové väzby s vodou alebo medzi nimi, čo spôsobuje rozdiel medzi fyzikálnymi vlastnosťami tiolov a alkoholov. Napríklad: metanotiol (Cho3Sh) má bod varu 6 ° C, zatiaľ čo metanol (Cho3Oh) Varuje pri 65 ° C.
Preto pri teplote miestnosti (25 ° C) metanol je kvapalina a metanotiol je plyn.
Stručne povedané: Tioles majú nižší bod varu, ako sú uvedené zodpovedajúce alkoholy. Z rovnakých dôvodov je rozpustnosť tiolov vo vode a v iných polárnych rozpúšťadlách veľmi nízka. Medzitým sú alkoholy s nízkou molekulovou hmotnosťou veľmi rozpustné vo vode.
Reaktivita
Spojenie S-H je slabšie ako väzba O-H, takže prepojte S-H ľahšie sa disociuje, takže tioly silné kyseliny ako alkoholy. Väčšina alkoholov má PKA medzi 16 a 18, zatiaľ čo tioles majú PKA okolo 11.
To umožňuje tioles-): Veľmi silné nukleofilné činidlo.
Skupina SH môže oxidovať za vzniku disulfidových väzieb (-S-s-), ktoré sú prítomné pri glutatiónovej oxidácii: tiol prítomný v bunkách a má antioxidačnú funkciu.
Bromo alebo iné halogény, ako aj kyslík, môžu pôsobiť na tiol, aby vytvorili mosty disulfur:
2 RSH +BR → R-S-S-R '+2 HBR
Zlúčeniny RSSR sú známe ako organické sulfidy a alkiily, r2Siež.
Na druhej strane silné oxidačné činidlá, ako je chlórnan sodný a peroxid vodíka, môžu pôsobiť na tioly, ktoré spôsobujú kyseliny sulfónovej:
Rsh +h2Ani2 → RSO3H +3 h2Ani
Menovanie
Nomenklatúra IUPAC pre tioly je veľmi podobná menom alkano, z ktorého sa k nemu pridáva prípona „tiol“.
Napríklad, thistan odvodený od Stano sa nazýva 1-butanotiol, ch3Chvály2Chvály2Chvály2Sh, naznačujúce číslo polohy skupiny SH v uhlíkoch reťazca.
Môže vám slúžiť: katión: školenie, rozdiely s aniónom a príkladmiRovnakým spôsobom je opäť ďalšia nomenklatúra podobná alkoholu: slovo „alkohol“ je nahradené „merkaptan“ v mene alkoholov. Napríklad Cho3Sh, analóg s metylalkoholom, ch3Och, nazýva sa metyl alebo merkaptan merkaptan.
Ďalším príkladom by bol Cho3Chvály2Ch (sh) ch3, nazývané 2-butanotiol, sekundárny obchodník alebo Merchandise Secbutil. To znamená, dôraz sa kladie na identitu R v receptúre RSH. Preto sú pre tioly splnené aj ďalšie normy nomenklatúry pre alkoholy.
A nakoniec, keď je skupina SH prítomná vo väčšej štruktúre alebo kde prevažujú najdôležitejšie skupiny, použije sa sulfihydrilo alebo merkapto predpona.
Napríklad zlúčenina ch3Chvály2CH (sh) Coch3 Nazýva sa 3-merkapto-2-penona. Všimnite si, že SH má menšiu prioritu ako okysličené skupiny (s výnimkou éteru), takže menšie číslice to zodpovedajú.
Syntéza
Metóda syntézy tiolov pozostáva z reakcie Tioty s alkylhalogenidom, ktorý produkuje strednú soľ izotiouron. Toto je hydrolyzované hydroxidom sodným na získanie tiolu a močoviny.
CH3SH sa pripravuje priemyselne reakciou sulfidu vodíka s metanolom v prítomnosti kyslých katalyzátorov:
Chvály3Oh +h2S → ch3Sh +h2Ani
V inej výrobnej metóde reaguje alkylhalogenid s hydrosulfuro sodným:
Rx +Nash → rsh +nax
Žiadosti
Oprava enzýmov spojená s nanočasticiami
Tioly sa používajú ako mosty na spojenie nanopartikula-enzýmových komplexov k zlatým elektródam. Napríklad tioly sa používajú na fixáciu komplexu nanočastíc-Uricasa, enzýmu, ktorý zasahuje do premeny kyseliny močovej na alantoín.
Reakcia tiol -no
Je to organická reakcia medzi tiolom a alkénom, ktorá nazýva reakciou „kliknutia“; To je okrem iných charakteristík, je to vysoko výkonná reakcia, široký rozsah, ktorý vytvára eliminovateľné produkty ne -chromatografickými metódami a ktoré sa tiež ľahko vykonáva.
Reakcia tiol -no má aplikácie v syntéze Tioazúcar: cukor prítomný v SaliCinolu, inhibítore a -glykozidázy. Salicinol bol izolovaný z rastlín používaných na Srí Lanke a Indii pri liečbe cukrovky.
Okrem toho sa reakcia tiol -no používa v chémii uhľohydrátov, polymerizácií, povrchovej chémie, chémie syntézy a chémie peptidov.
Môže vám slúžiť: bod mrazu: Ako ho vypočítať a príkladyZápach
 Kuchynský plyn je toaleta, ale vďaka zloženiu tiolov s nízkou molekulovou hmotnosťou má výrazný zápach
Kuchynský plyn je toaleta, ale vďaka zloženiu tiolov s nízkou molekulovou hmotnosťou má výrazný zápach Alifatické tioly s nízkou molekulovou hmotnosťou sú začlenené do zemných plynov, takže ich silný zápach slúži ako varovanie tvárou v tvár úniku alebo úniku plynu.
Liek
Penicilamín (c5HjedenásťNie2S) Je to liek používaný pri liečbe Wilsonovej choroby a reumatoidnej artritídy.
A kaptopril (c9HpätnásťNie3S), na druhej strane sa používa pri liečbe arteriálnej hypertenzie a kongestívneho srdcového ochorenia.
Obidva sú príkladmi tiolov s liečivými aplikáciami.
Biologický
Skupiny Tioles sú prítomné, okrem iných zlúčenín s biologickou funkciou, v cysteíne, koenzýme A a glutatión.
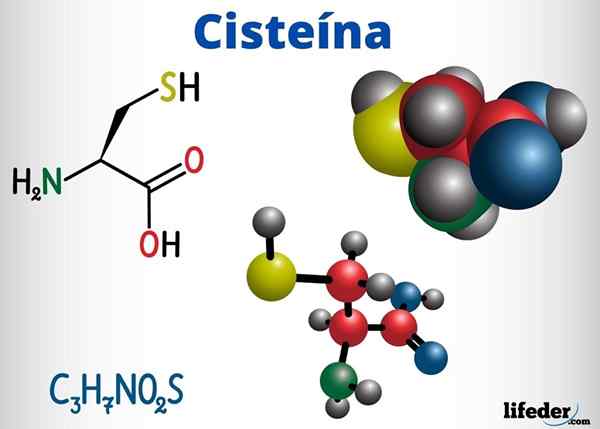
Cysteín je aminokyselina schopná tvoriť disulfurové mosty vo svojom proteínovom reťazci, a preto zodpovedná za terciárnu štruktúru proteínu. Môže tiež tvoriť disulfurové mosty medzi rôznymi proteínovými reťazcami, čo spôsobuje kvartérnu štruktúru proteínov.
Cysteín sa nachádza v aktívnych centrách mnohých enzýmov a má tiež antioxidačný účinok.
Glutation je veľmi dôležitý antioxidačný intracelulárny účinok, ktorý udeľuje ochranu bunkám a makromolekúl, ktoré ho tvoria.
Na druhej strane koenzým A je tiol, ktorý zasahuje do syntézy a oxidácie mastných kyselín. Okrem toho, koenzým vo forme acetylcoenzým A zasahuje na začiatku cyklu kyseliny citrónovej alebo Krebsovho cyklu.
Príklady
Nakoniec budú uvedené niektoré názvy tiol, sprevádzané ich molekulárnymi vzorcami:
-Kyselina tiooctová (c2H4Ty)
-Koenzým A (CdvadsaťjedenH36N7Ani16P3S)
-Znížená glutácia (C10H17N3Ani6S)
-Cysteín (c3H7Nie2S)
-Merkaptanol (c2H6Ty)
-Metanotiol (ch3Sh)
-1-propanotiol (c3H7Sh)
-Butanotiol (c4H 9Sh)
-Tiofenol alebo tiomerosal (c6H6S)
-Pomelo mercaptano (c10H18S)
-Hexadecanotiol (c6H3. 4S)
-Penicilamín (c6HjedenásťNie2S)
-Captopril (c9HpätnásťNie3S)
-Etanotiol (c2H6S)
-2-propenetiol (c3H6S)
-A-lipoický alebo lipoamid (c8H14Ani2Siež2). Je to cyklický disulfid.
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10th Vydanie.). Wiley Plus.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Morrison a Boyd. (1987). Organická chémia. (Piate vydanie). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Tiol. Zdroj: In.Wikipedia.orgán
- DR. Dietmar Kennepohl a kol. (13. september 2020). Tioly a sulfidy. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Redaktori Enyclopaedia Britannica. (2020). Tiol. Získané z: Britannica.com
- Nolan MD a Scanlan EM (2020) Aplikácie chémie tiol-Eene pre peptidovú vedu. Predná strana. Chem. 8: 583272. Doi: 10.3389/fchem.2020.583272
- DR. Carl C. Klenot. (1999). Kapitola 9: Alkoholy a tioly. Zdroj: Web.Pdx.Edu

