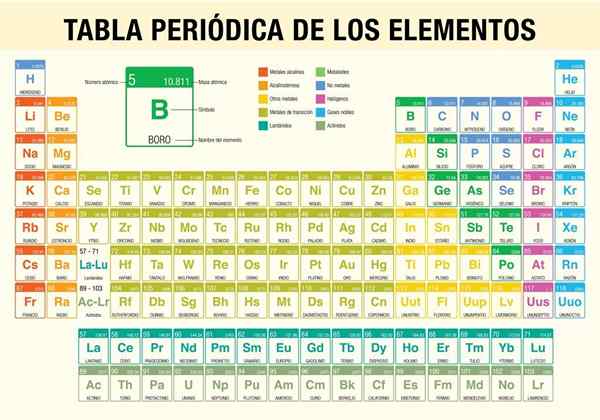
pravidelná tabuľka prvkov
- 4205
- 331
- Blažej Hrmo
Aká je periodická tabuľka prvkov?
Ten pravidelná tabuľka prvkov Je to nástroj, ktorý vám umožňuje konzultovať chemické vlastnosti doteraz známych 118 prvkov. Je nevyhnutné pri vykonávaní stechiometrických výpočtov, predpovedá fyzikálnych vlastností prvku, ich klasifikáciu a nájdenie pravidelných vlastností medzi všetkými z nich.
Atómy sa stávajú ťažšími, pretože ich jadrá pridávajú protóny a neutróny, ktoré musia byť sprevádzané aj novými elektrónmi; Inak by elektronická tvorba nebola možná. Niektoré atómy sú teda veľmi ľahké, ako napríklad vodík a iné, superpesados, ako napríklad Oganerson.
Bol to vedec Dmitri Mendeléyev, ktorý v roku 1869 (takmer pred 150 rokmi) uverejnil po desiatich rokoch teoretických štúdií a experimentov prvú periodickú tabuľku v snahe zorganizovať 62 prvkov známych v tom čase.
Čo je periodická tabuľka pre?
Hlavné použitia tabuľky sú:
- Poznať symbol a názov každého chemického prvku, ktorý existuje.
- Poznať atómovú hmotnosť a atómové číslo prvku.
- Informovať o vzťahoch medzi rôznymi prvkami.
- Ukážte rôzne trendy (periodicita).
- Klasifikácia typov chemických prvkov. Tieto typy zahŕňajú alkalické kovy, základné kovy, prechodné kovy, nemetály, ušľachtilé plyny, halogény, alkalické pozemky, semimetály, aktinidy a lanthanidy.
- Predpovedať vlastnosti nových prvkov, ktoré sa ešte nezistili alebo nie sú syntetizované.
Ako je organizovaná periodická tabuľka? (Štruktúra a organizácia)
Obdobia
Prvky sú usporiadané v riadkoch alebo obdobiach v závislosti od úrovne energetiky jej orbitálov. Pred obdobím 4, keď prvky nasledovali v rastúcom poradí atómovej hmoty, bolo to, že pre každých osem z nich sa chemické vlastnosti znova opakovali (zákon Octave, John Newlands).
Kovové kovy sa vkradli do iných nemetalických prvkov, ako je síra a fosfor. Z tohto dôvodu bol vstup kvantovej fyziky a elektronických konfigurácií na pochopenie moderných periodických tabuliek životne dôležitý.
Orbitály energetickej vrstvy sú naplnené elektrónmi (a jadrami protónov a neutrónov), pretože sa pohybuje po určitú dobu. Táto energetická vrstva ide ruka v ruke s atómovou veľkosťou alebo rádiom; Preto sú prvky vyšších období menšie ako tie, ktoré sa nachádzajú nižšie.
H a ja som našiel v prvej (perióde) energetickej úrovni; Prvý riadok sivých škatúľ v štvrtom období; a riadok boxov Ananjadas, v šiestom období. Všimnite si, že hoci sa zdá, že tento je v údajnom deviatom období, v skutočnosti patrí do šiestej, hneď za žltou škatuľou BA.
Zoskupovať
Turna v období je, že sa zvyšuje hmota, počet protónov a elektrónov. V rovnakom stĺpci alebo skupine, hoci sa hmota a protóny líšia, počet Elektróny vrstvy Valencia je rovnaký.
Napríklad v prvom stĺpci alebo skupine má H iba jeden elektrón na orbitáli 1S1, Ako Li (2s1), Sodík (3s1), Draslík (4s1) A tak ďalej na Francio (7s1). To číslo 1 označuje, že tieto prvky majú sotva elektrón vo Valencii, a preto patria do skupiny 1 (AI). Každý prvok je v rôznych obdobiach.
Bez počítania vodíka, zelenej skrinky sú prvky pod ňou z oranžových škatúľ a nazývajú sa alkalické kovy. Ešte v pravom políčku v akomkoľvek období je skupina alebo stĺpec 2; to znamená, že jeho prvky majú dva valenčné elektróny.
Môže vám slúžiť: teoretický výkonAle keď sa presuniete doprava, bez vedomia orbitálov D sa dostanete do skupiny Boro (B) alebo skupiny 13 (IIIA); Namiesto skupiny 3 (IIIB) alebo Scandio (SC). Berúc do úvahy vyplnenie orbitálov D, obdobia sivých škatúľ sa začnú cestovať: prechodné kovy.
Čísla protónov verzus elektróny vo Valencii
Pri štúdiu periodickej tabuľky môže vzniknúť zámeny medzi atómovým počtom Z alebo počtom celkových protónov v jadre a množstvom valenčných elektrónov. Napríklad uhlík má z = 6, to znamená, že má šesť protónov, a preto šesť elektrónov (inak to nemohol byť atóm s neutrálnym zaťažením).
Ale z týchto šiestich elektrónov, Štyri sú z Valencie. Z tohto dôvodu je jeho elektronická konfigurácia [on] 2s22 P2. [Označuje dva elektróny 1s2 uzavretej vrstvy a teoreticky sa nezúčastňujú na tvorbe chemických väzieb.
Pretože uhlík má štyri valenčné elektróny, „pohodlne“ sa nachádza v skupine 14 (DPH) periodickej tabuľky.
Prvky pod uhlíkom (áno, GE, SN, PB a FL) majú viac vyšších atómových (a atómových) čísel; Ale každý má spoločné štyri elektróny vo Valencii. To je kľúč k pochopeniu, prečo prvok patrí do jednej skupiny a nie druhej.
Prvky periodickej tabuľky
Blok S
Ako je vysvetlené, skupiny 1 a 2 sa vyznačujú tým, že majú jeden alebo dva elektróny na orbitáloch S. Tieto orbitály sú sférická geometria a keďže ktorákoľvek z týchto skupín zostúpi, prvky získavajú vrstvy, ktoré zväčšujú veľkosť svojich atómov.
Na prezentáciu silných trendov v ich chemických vlastnostiach a spôsoboch reagovania sú tieto prvky organizované ako blok S. Preto do tohto bloku patria alkalické kovy a alkalinery kovy. Elektronická konfigurácia prvkov tohto bloku je NS (1s, 2s atď.).
Aj keď je héliový prvok na pravom hornom konci tabuľky, jeho elektronická konfigurácia je 1S2 A preto patrí do tohto bloku.
Blok p
Na rozdiel od blokov S, prvky tohto bloku sú prítomné úplne plné orbitály, zatiaľ čo ich p orbitály naďalej plnia elektrónmi. Elektronické konfigurácie prvkov patriacich do tohto bloku sú typu NS2Np1-6 (P orbitály môžu mať na vyplnenie jedného alebo až šiestich elektrónov).
Takže v ktorej časti periodickej tabuľky je tento blok? Vpravo: zelené, obytné a modré škatule; To znamená, že nemetalické prvky a ťažké kovy, ako je bizmut (BI) a olovo (PB).
Počnúc bórom, elektronickou konfiguráciou NS2Np1, Uhlík na pravej strane dodáva ďalší elektrón: 2s22 P2. Potom elektronické konfigurácie ostatných prvkov obdobia 2 bloku P sú: 2s22 P3 (dusík), 2s22 P4 (kyslík), 2s22 P5 (fluorid) a 2s22 P6 (Neón).
Ak sa znížia nižšie obdobia, bude mať úroveň energie 3: 3s23p1-6, A tak ďalej až do konca bloku P.
Všimnite si, že najdôležitejšou vecou v tomto bloku je, že z obdobia 4 jeho prvky úplne vyplnili orbitály (modré škatule ďalej doprava). Stručne povedané: blok S je vľavo od periodickej tabuľky a blok p, doprava.
Reprezentatívne prvky
Aké sú reprezentatívne prvky? Sú to tie, ktoré na jednej strane ľahko stráca elektróny alebo na druhej strane, vyhrávajú ich, aby dokončili oktet Valencia. Inými slovami: sú to prvky blokov s a p.
Môže vám slúžiť: emulgátor: proces emulzie, molekulárne aspekty, aplikácieIch skupiny sa odlišovali od ostatných pomocou listu A na konci. Teda tam bolo osem skupín: od AI do VIIIA. Ale v súčasnosti je systém číslovania používaný v moderných periodických tabuľkách arabsky od 1 do 18 vrátane prechodných kovov.
Z tohto dôvodu môže byť skupina Boro IIIA alebo 13 (3+10); uhlíková skupina, DPH alebo 14; a to z ušľachtilých plynov, posledné právo na stôl, viiia alebo 18.
Prechodné kovy
Prechodné kovy sú všetky prvky sivých škatúľ. Počas celého obdobia sú naplnené ich orbitály, ktoré sú päť, a preto môžu mať desať elektrónov. Pretože desať elektrónov by malo vyplniť orbitály, potom musí byť desať skupín alebo stĺpcov.
Každá z týchto skupín v starom systéme číslovania bola označená s rímskymi číslami a písmenom B na konci. Prvou skupinou, skupina Škandio, bola IIIB (3), železo, kobalt a nikel VIIIB za to, že majú veľmi podobné reaktivity (8, 9 a 10) a zinok IIB (12).
Ako je vidieť, je oveľa ľahšie rozpoznať skupiny podľa arabských čísel ako používanie rímskych čísel.
Vnútorné prechodné kovy
Z obdobia 6 periodickej tabuľky začnú orbitály f energeticky dostupné. Musia byť vyplnené ako prvé ako orbitály D; A preto sú jeho prvky zvyčajne oddelené, aby sa stôl príliš nerozšíril.
Posledné dve obdobia, oranžové a sivé. Existuje sedem orbitálov F, ktoré potrebujú na vyplnenie štrnásť elektrónov, a preto musí existovať štrnásť skupín.
Ak sa tieto skupiny pridajú do periodickej tabuľky, bude 32 (18 + 14) a bude mať „predĺženú“ verziu:
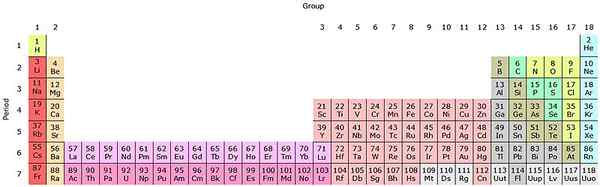 Zdroj: od Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons
Zdroj: od Sandbh [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons Čistý ružový rad zodpovedá lantanoidom, zatiaľ čo tmavo ružový rad aktinoidov. Lantano, s Z = 57, Actinio, AC so Z = 89 a celý blok F patrí do tej istej skupiny Scandio. Pretože? Pretože Scandio má nd orbitál1, ktorý je prítomný vo zvyšku latanoidov a aktinoidov.
AC majú nastavenia 5D Valencia16s2 a 6d17s2. Keď sa pohybujete priamo v oboch radoch, začnú sa vyplniť orbitály 4F a 5F. Akonáhle je naplno, dosiahnete prvky Luthacio, Lu a Laurencio, LR.
Kovy a non -metal
Opustenie koláča periodickej tabuľky pozadu je pohodlnejšie uchýliť sa k vynikajúcemu obrazu, dokonca aj vo svojej predĺženej podobe. V súčasnosti sú drvivá väčšina vyššie uvedených prvkov kovy.
Pri teplote miestnosti sú všetky kovy pevné látky (s výnimkou ortuti, ktorá je kvapalina) striebornej šedej (s výnimkou medi a zlata). Zvyčajne sú tvrdé a brilantné; Aj keď sú bloky S mäkké a krehké. Tieto prvky sa vyznačujú ich ľahkosťou straty elektrónov a formovania katiónov m+.
V prípade lantanoidov stratia tri elektróny 5D16s2 Stať sa trivalentnými katiónmi m3+ (ako ona3+). Hill medzitým dokáže stratiť štyri elektróny (CE4+).
Na druhej strane, nemetalické prvky tvoria najmenšiu časť periodickej tabuľky. Sú to plyny alebo tuhé látky s kovalentne prepojenými atómami (ako je síra a fosfor). Všetky sa nachádzajú v bloku P; Presnejšie povedané, v hornej časti, keď zostupne na nižšie obdobia zvyšuje kovový charakter (Bi, Pb, PO).
Okrem toho ich vyhrá non -metals namiesto straty elektrónov. Takto tvoria anióny x- S rôznymi negatívnymi zaťaženiami: -1 pre halogény (skupina 17) a -2 pre kalkogény (skupina 16, kyslík).
Môže vám slúžiť: etylalkohol: štruktúra, vlastnosti, použitie, získanieKovové rodiny
V rámci kovov existuje interná klasifikácia na ich odlíšenie od:
- Skupina 1 kovy sú zásadité.
- Skupina 2, alkaLinerrior kovy (SR. Schoambara).
- Skupina 3 (IIB) Scandio Family. Táto rodina sa skladá zo škandia, vedúceho skupiny Ititrium a z Lantana, Actinio a všetkých lantanoidov a aktinoidov.
- Skupina 4 (IVB), Titanium Family: Ti, Zr (Circonium), HF (Hafnio) a RF (Rutherfordio). Koľko má elektróny vo Valencii? Odpoveď je vo vašej skupine.
- Skupina 5 (VB), rodina Vanadio. Skupina 6 (VIB), rodina Chrome. A tak ďalej do rodiny zinku, skupina 12 (IIB).
Hatule
Kovový charakter sa zvyšuje z pravej doľava a zhora nadol. Ale aká je hranica medzi týmito dvoma typmi chemických prvkov? Táto hranica sa skladá z prvkov známych ako metaloidy, ktoré majú charakteristiky kovov aj non -metalov.
Metaloidy je možné vidieť v periodickej tabuľke v „schodisku“, ktoré začína bórmi, a končí v rádioaktívnom prvku Astata. Tieto prvky sú:
- B: Boro.
- Kremík: Áno.
- GE: Germanio.
- Ako: arzén.
- SB: Antimón.
- TE: Telurio.
- At: Astato.
Každý z týchto siedmich prvkov vykazuje stredné vlastnosti, ktoré sa líšia podľa chemického prostredia alebo teploty. Jednou z týchto vlastností je polovodič, to znamená, že metaloidy sú polovodiče.
Plyny
Za suchozemských podmienok sú plynné prvky tie, ktoré nie sú osvetľovacie kovy, ako je dusík, kyslík a fluór. Túto klasifikáciu vstupujú aj chlór, vodík a ušľachtilé plyny. Z všetkých z nich sú najmodernejšími ušľachtilými plynmi, pretože ich nízka tendencia reagovať a správať sa ako voľné atómy.
Ten sa nachádza v skupine 18 periodickej tabuľky a sú:
- Helio, on.
- Neón, NE.
- Argon, AR.
- Kripton, KR.
- Xenón, XE.
- Radón, Rn.
- A posledné zo všetkých, vznešený syntetický oganénový plyn, OG.
Všetky ušľachtilé plyny majú spoločné konfiguráciu Valencia ns2Np6; to znamená, že majú dokončené oktet Valencia.
Agregačné stavy na iné teploty
Prvky sú v pevnom, kvapalnom alebo plynnom stave v závislosti od teploty a sily ich interakcií. Ak sa teplota Zeme ochladí, až kým nie je absolútna nula (0 k), potom by všetky prvky zmrazili; s výnimkou hélia, ktoré by kondenzovalo.
Pri tejto extrémnej teplote by ostatné plyny boli vo forme ľadu.
Na druhej strane, ak by teplota bola približne 6000 K, „všetky“ prvky by boli v plynnom stave. Za týchto podmienok mohli doslova pozorovať oblaky zlata, striebra, olova a iných kovov.
Dôležitosť pravidelnej tabuľky
V súčasnosti je pravidelná tabuľka najdôležitejším organizačným nástrojom chémie kvôli podrobným vzťahom jej prvkov. Jeho použitie je nevyhnutné pre študentov aj učiteľov, ako aj pre výskumných pracovníkov a mnohých odborníkov venovaných odvetviu chémie a inžinierstva.
Pri pohľade na periodickú tabuľku sa rýchlo a efektívne získava obrovské množstvo a informácie, napríklad:
- Lítium (Li), berylium (BE) a bór (b) vykonávajú elektrinu.
- Lítium je alkalický kov, berylium je zásadný kov a bór nie je kov.
- Lítium je najlepším vodičom troch pomenovaných, nasledovaných Beryliam a nakoniec Boron (polovodič).
Teda lokalizáciou týchto prvkov v periodickej tabuľke je možné okamžite uzavrieť jeho tendenciu k elektrickej vodivosti.