Sulfid zinočnatia (Zns)
- 3004
- 696
- Ing. Ervín Petruška
 Sulfid zinku. Zdroj: Wikimedia Commons
Sulfid zinku. Zdroj: Wikimedia Commons Čo je sulfid zinku?
On Sulfid zinku Je to anorganická zlúčenina vzorca znS, tvorené Zn katiónmi2+ a anióny s2-. Nachádza sa v prírode hlavne ako dva minerály: Wurtzite a Sfeny (alebo Blenda zinku), pričom druhá je jej hlavnou formou.
Sphenhell je prezentovaný v čiernej povahe kvôli nečistotám, ktoré predstavuje. Čisto predstavuje biele kryštály, zatiaľ čo Wurtzita má sivé biele kryštály.
Sulfid zinočnatého je nerozpustný vo vode. Môže spôsobiť poškodenie životného prostredia, pretože preniká do zeme a kontaminuje podzemnú vodu a ich prúdy.
Okrem iných reakcií sa môže vyskytnúť sulfid zinočnatého, korózia a neutralizácia.
Koróziou:
Zn +H2S => Zns +h2
Neutralizáciou:
H2S +Zn (OH)2 => Zns +2h2Ani
Sulfid zinku je fosforeskujúca soľ, ktorá jej dodáva kapacitu viacnásobných použití a aplikácií. Okrem toho je to polovodič a fotokatizácia.
Štruktúra sulfidu zinku
Sulfid zinku prijíma kryštalické štruktúry riadené elektrostatickými atrakciami medzi katiónom Zn2+ a anión s2-. Sú to dva: sfény alebo zinočnaté Blenda a Wurzita. V obidvoch iónov minimalizujú odpor medzi rovnakými iónmi.
Blenda zinku je najstabilnejšia v pozemských podmienkach tlaku a teploty; A Wurzita, ktorá je menej hustá, je výsledkom kryštalickej reorganizácie v dôsledku zvýšenia teploty.
Obidve štruktúry môžu existovať v rovnakej zns tuhej farbe súčasne, aj keď Wurzita veľmi pomaly skončí prevažne.
Zinková zmes
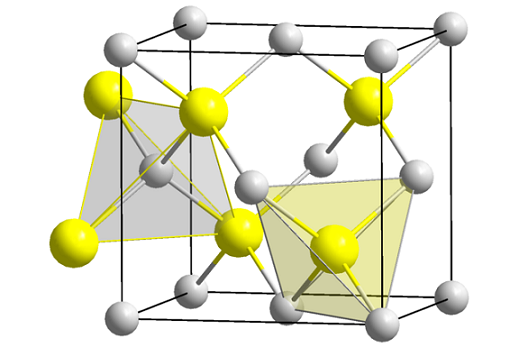
 Štruktúra zinkovej zmesi (Sfeny). Zdroj: Wikimedia Commons
Štruktúra zinkovej zmesi (Sfeny). Zdroj: Wikimedia Commons Vynikajúci obrázok ukazuje kubickú bunku sústredenú na tvári štruktúry zinkovej zmesi. Žlté gule zodpovedajú aniónom S2-, a šedé až Zn katióny2+, Nachádza sa v rohoch a v centrách tváre kocky.
Môže vám slúžiť: ISOBUTIL: Nomenklatúra, školenie, štruktúra a vlastnostiVšimnite si tetraedrálne geometrie okolo iónov. Zinková zmes môže byť tiež reprezentovaná títo tetraedra, ktorej diery vo vnútri skla majú rovnakú geometriu (tetraedrálne dutiny).
Podiel ZnS je tiež splnený v jednotkových bunkách; to znamená pomer 1: 1. Tak pre každú katión Zn2+ Existuje anión s2-. Na obrázku sa môže zdať, že sivé gule oplývajú, ale v skutočnosti, keď sú v rohoch a v strede rozbočovacích tvárí, zdieľajú iné bunky.
Napríklad, ak sú odobraté štyri žlté gule, ktoré sú vo vnútri škatule, „kúsky“ všetkých sivých guľôčok okolo by mali pridať to isté (a robiť to), štyri. V kubickej jednotnej bunke sú teda štyri Zn2+ a štyri s2-, ZNS stechiometrický pomer je splnený.
Podobne je dôležité zdôrazniť, že existujú tetraedrálne diery vpred a za žlté gule (priestor, ktorý ich oddeľuje od seba).
Wurzita
 Šťavnatá štruktúra. Zdroj: Wikimedia Commons
Šťavnatá štruktúra. Zdroj: Wikimedia Commons Na rozdiel od štruktúry zinkovej zmesi, Wurzita prijíma šesťuholníkový kryštalický systém (vynikajúci obraz). Je to menej kompaktné, takže tuhá látka má menšiu hustotu.
Ióny v Wurzite majú tiež tetraedrálne prostredie a pomer 1: 1, ktorý súhlasí s vzorcom ZNS.
Vlastnosti sulfidu zinku
Farba
Môže byť prezentovaný tromi spôsobmi:
-Wurtzita z bielych a hexagonálnych kryštálov.
-Sphenhell z bielych kryštálov a kubických kryštálov.
-Ako biely až šedý alebo žltkastý biely prášok a kubické žltkasté kryštály.
Bod topenia
1.700 ° C.
Rozpustnosť
Prakticky nerozpustné (0,00069 g/100 ml pri 18 ° C).
Rozpustnosť
Nerozpustné v alkaloch, rozpustné v zriedených minerálnych kyselinách.
Hustota
Gule 4,04 g/cm3 a Wurtzita 4,09 g/cm3.
Tvrdosť
Má tvrdosť 3 až 4 na stupnici Mohs.
Stabilita
Pri obsahu vody pomaly oxiduje sulfát. V suchom prostredí je stabilný.
Rozklad
Keď sa zahrieva pri vysokých teplotách, emituje výpary toxického zinku a sírnych oxidov.
Môže vám slúžiť: hydrid sodný (NAH): vlastnosti, reaktivita, nebezpečenstvo, použitieNomenklatúra sulfidu zinku
Elektronická konfigurácia Zn je [AR] 3D104s2. Pri strate dvoch elektrónov orbitálu 4S je to ako katión Zn2+ S orbitálmi plných. Preto, pretože elektronicky Zn2+ Je oveľa stabilnejší ako Zn+, Má iba valenciu +2.
Preto je vynechaný pre nomenklatúru zásob, pridáva svoju valenciu uzavretú v zátvorkách a s rímskymi číslami: sulfid zinočnatého (II).
Systematické a tradičné nomenklatúry
Existujú však aj iné spôsoby, ako zavolať Zns okrem toho, že už bol zvýšený. V systematicky je počet atómov každého prvku špecifikovaný s gréckymi čitateľmi, s jedinou výnimkou prvku napravo, keď je iba jeden. Zns je teda pomenovaný ako: buchtaSulfid zinočnatia (a nie monozinc monosulfuro).
Pokiaľ ide o tradičnú nomenklatúru, do zinku pri jednej valencii +2, pridáva sa pridaním prípony -Co. V dôsledku toho je jeho tradičný názov: Zínc sulfidICO.
Používa sulfid zinku
Ako pigmenty alebo povlaky
Sachtolit
Sachtolit je biely pigment vyrobený zo sulfidu zinočnatého. Používa sa v tmelkách, mastiláciách, tmelu, dolných krytoch, latexových farbách a značení.
Jeho použitie kombinované s absorpčnými pigmentmi ultrafialového svetla, ako je mikro titán alebo priehľadné pigmenty oxidu železa, je potrebné v pigmentoch rezistentných na počasie.
Zns a latexové obrazy
Keď sa zns aplikuje v latexových alebo textúrovaných obrazoch, má predĺžené mikrobicídne pôsobenie.
Okná a lietadlá
Vďaka svojej veľkej tvrdosti a odporu voči rozbitiu, erózii, dažďu alebo prachu je vhodný pre vonkajšie infračervené okná alebo v rámci lietadiel.
Povlak a iné použitia
Zns sa používa pri nátere rotorov používaných pri transporte zlúčenín, na zníženie opotrebenia. Okrem toho sa používa pri výrobe tlačových atramentov, izolačných zlúčenín, termoplastickej pigmentácie, plastov odolných voči elektroluminiscenčným plameňom a žiarovkám.
Môže vám slúžiť: Tunsen zapaľovač: Charakteristiky, funkcie, príklady použitiaZariadenia a obrazovky nočného videnia
-Sulfid zinku môže byť transparentný a je možné použiť ako okno na viditeľnú optiku a infračervú optiku. Používa sa v zariadeniach Night Vision, na televíznych obrazovkách, radarových obrazovkách a žiarivých povlakoch.
Elektroluminiscencia
Zns doping s Cu sa používa pri výrobe elektroluminiscenčných panelov. Okrem toho sa používa v raketovom pohone a gravimetrii.
Pre jeho fosforescenciu
Jeho fosforescencia sa používa na farbenie ihiel hodín a tak vizualizáciu času v tme; Tiež v maľbách pre hračky, núdzové signály a upozornenia na dopravu.
Fosforescencia umožňuje použitie sulfidu zinočnatého v trubiciach katódového lúča a na obrazovkách X -Bay, aby žiarili v tmavých bodoch. Farba fosforescencie závisí od použitého aktivátora.
Polovodič, fotokatizácia a katalyzátor
- Sfeny a Wurtzite sú širokopásmové rozštiepené polovodiče. Sphalerit má rozštiepenie 3,54 eV, zatiaľ čo Wurtzita má 3,91 ev -pásmový bit.
- Zns sa používa pri príprave fotokatalyzátora zloženého z CdS - Zns/zirkónia - titánový fosfát, používaný na výrobu vodíka pri viditeľnom svetle.
- Zasahuje ako katalyzátor degradácie organických znečisťujúcich látok. Používa sa pri príprave farebného synchronizátora v LED žiarovkách.
- Jeho nanokryštály sa používajú na detekciu ultrasentibilných proteínov. Napríklad vydaním kvantových bodov Zns. Používa sa na prípravu kombinovaného fotokatalyzátora (CDS/ZNS) -Tio2 na elektrickú výrobu prostredníctvom fotoelektrokatalýzy.
Odkazy
- Pubchem (2018). Sulfid zinku. Zobraté z: pubchem.Ncbi.NLM.NIH.Vláda
- Quiminet (16. januára 2015). Biely pigment založený na sulfide zinočnatého. Získané z: Quiminet.com
- Wikipedia (2018). Sulfid zinku. Prevzaté z: v.Wikipedia.orgán
- II-VI UK (2015). Sulfid zinočnatia (Zns). Prevzaté z: II-VI.je
- Rob Toreki (30. marca 2015). Štruktúra zinkovej (Zns). Prevzaté z: ilpi.com
- Chemistry Librettexts (22. januára 2017). Blenda štruktúry-zinok (ZNS). Prevzaté z: chem.Librettexts.orgán
- Reade (2018). Sulfid sulfid/ zinok (ZNS). Zobraté z: Reade.com

