Štruktúra sulfátu medi (CUSO4), vlastnosti, získanie, použitia
- 1699
- 327
- Mgr. Pravoslav Mokroš
On sulfát medi Je to anorganická zlúčenina tvorená meďou (Cu), sírou (S) a kyslíkovými (O) prvkami (O). Jeho chemický vzorec je cuso4. Meď je v stave oxidácie +2, síry +6 a kyslík má valenciu -2.
Je to biela tuhá látka, že keď je vystavená vlhkosti životného prostredia, sa stáva jeho cuso modrým pentahydrátom4 •5H2Ani. Biela tuhá látka sa získa zahrievaním modrej, aby sa eliminovala voda.
 Sulfát medi (CUO4) bezvodia (bez vody v jej kryštalickej štruktúre). W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Sulfát medi (CUO4) bezvodia (bez vody v jej kryštalickej štruktúre). W. Oelen/cc By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Po stáročia sa používa ako antibakteriálne činidlo na liečenie rán u ľudí a zvierat. Funguje tiež ako fungicíd, ako astringent, antidiarhal a kontrola črevných chorôb u zvierat. Používa sa tiež ako činidlo antihongos v rastlinách.
Niektoré z ich použití však boli prerušené, pretože ich prebytok môže byť toxický pre ľudí, zvieratá a rastliny. Interval koncentrácií, v ktorom sa môže použiť, je úzky a závisí od druhu.
Používa sa ako katalyzátor v chemických reakciách a ako rozpúšťadlá vysušené. Umožňuje zlepšiť odpor a flexibilitu niektorých polymérov.
Nadmerné množstvo tejto zlúčeniny môže byť škodlivé pre pôdy, pretože je toxické pre mikroorganizmy, ktoré sú prospešné pre rastliny.
[TOC]
Štruktúra
Sulfát medi je tvorený medeným iónom (Cu2+) a sulfátový ión (tak42-).
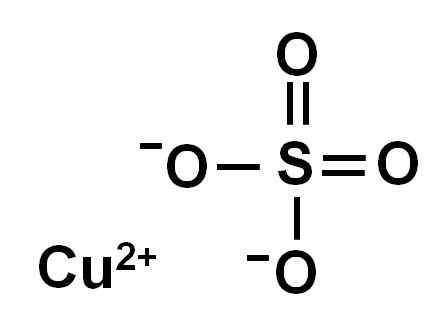 Ionica sulfát meďnatého (II). Autor: Marilú Stea.
Ionica sulfát meďnatého (II). Autor: Marilú Stea. V dôsledku straty dvoch elektrónov má ión medi (II) nasledujúcu elektronickú konformáciu:
1s2 2s2 2 P6 3s2 3p6 3D9
Je zrejmé, že orbitál má 3D neúplný (má 9 elektrónov namiesto 10).
Menovanie
- Sulfát bezvodého medi
- Sulfát medi (II)
- Sulfát
Vlastnosti
Fyzický stav
Zelenkavo biela tuhá látka alebo krištáľovo tvare.
Molekulová hmotnosť
159,61 g/mol
Bod topenia
Pri 560 ° C sa rozkladá.
Hustota
3,60 g/cm3
Rozpustnosť
22 g/100 g vody pri 25 ° C. Nerozpustný v etanole.
Chemické vlastnosti
Ak je vystavená vlhkosti vzduchu pod 30 ° C, stane sa zlúčeninou cuso pentahydrátu4 •5H2Ani.
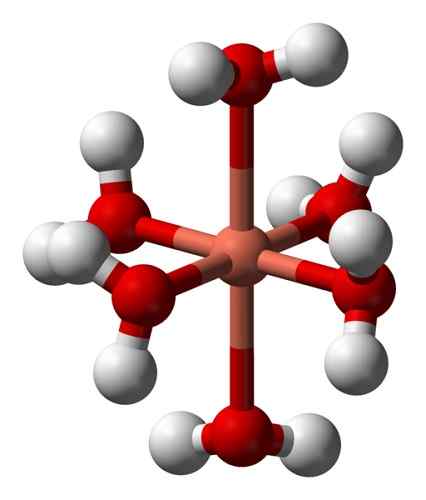
Jeho vodné roztoky sú modré kvôli tvorbe hexaakuocobre iónu (II) [Cu (H (H2Buď)6]2+ čo vytvára také sfarbenie. V tomto ióne sú dve molekuly vody ďalej od kovového atómu ako ostatné štyri.
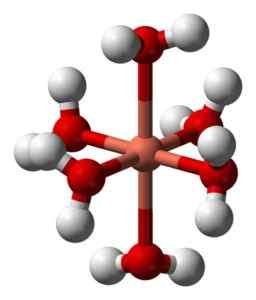 Deformovaná štruktúra hexaacuocobre iónu (II) [Cu (H2Buď)6]2+. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons.
Deformovaná štruktúra hexaacuocobre iónu (II) [Cu (H2Buď)6]2+. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons. Dôvodom je takzvaný efekt Jahn-Teller, ktorý predpovedá, že tento typ systémov zažíva skreslenie spôsobené skutočnosťou, že Cu2+ Má elektronickú štruktúru, ktorá končí v D9, to znamená, že neúplný orbitál (bolo by úplné, keby bol d10).
Môže vám slúžiť: Hydroxid vápenatý (Ca (OH) 2): Štruktúra, vlastnosti, získanie, použitiaAk sa pridá amoniak (NH3) Tieto riešenia sa tvoria, v ktorých NH3 Molekuly vody postupne vytesňujú. Sú tvorené napríklad z [cu (NH3) (H2Buď)5]2+ Do [cu (nh3)4(H2Buď)2]2+.
Keď cuso4 Zohrieva sa na svoj rozklad emituje toxické plyny a stáva sa oxidom Cupric.
Získanie
Bezvodý sulfát medi sa dá získať celkovou dehydratáciou pentahydrátovej zlúčeniny, ktorá sa dosiahne zahrievaním, až kým sa molekuly vody neodparú.
Cuso4 •5H2O + teplo → cuo4 + 5 h2Alebo ↑
Pentahydrátová zlúčenina je modrá, takže voda Cuso sa získa pri strate kryštalizačnej vody4 Biely bezvodý.
Žiadosti
Niektoré z jeho použití sa prekrývajú s použitím zlúčeniny pentahydrátu. Iné sú špecifické pre bezvodú látku.
Ako antibakteriálne činidlo
Má potenciál ako antimikrobiálne činidlo. Používa sa už tisíce rokov, dokonca aj v kultúrach Južnej Ameriky a Strednej Ameriky, na zabránenie infekcie rany prostredníctvom gázy impregnovanej v roztoku tejto zlúčeniny.
Odhaduje sa, že v mechanizme jeho antibakteriálnej aktivity ióny cu2+ Tvoria cheláty s enzýmami, ktoré sú rozhodujúce pre bunkové funkcie baktérií, deaktivujú ich. Indukujú tiež tvorbu hydroxylových radikálov OH •, ktoré poškodzujú baktériové membrány a ich DNA.
 Cuso4 Môže to fungovať proti niektorým patogénnym baktériám. Autor: Gerd Altmann. Zdroj: Pixabay.
Cuso4 Môže to fungovať proti niektorým patogénnym baktériám. Autor: Gerd Altmann. Zdroj: Pixabay. Nedávno sa uvádza, že CUSO stopy4 Môžu zvýšiť antimikrobiálnu aktivitu prírodných produktov bohatých na polyfenoly, ako sú granátové extrakty a infúzie niektorých druhov čajových rastlín.
Vo veterinárnych aplikáciách
Používa sa ako antiseptikum a astringent pre sliznice a na liečbu vonkajšej konjunktivitídy a zápalu zápalu. Slúži na vykonávanie terapeutických alebo profylaktických kúpeľov, aby sa zabránilo hnilobe hovädzieho dobytka, oviec a iných cicavcov.
 Cuo vodné roztoky4 Slúžia na vyliečenie otvorov hovädzieho dobytka. Autori: Ingrid und Stefan Melichar. Zdroj: Pixabay.
Cuo vodné roztoky4 Slúžia na vyliečenie otvorov hovädzieho dobytka. Autori: Ingrid und Stefan Melichar. Zdroj: Pixabay. Slúži ako žieravé činidlo pre nekrotické masy na končatinách hovädzieho dobytka, vredov stomatitídy a granulovaného tkaniva z nich. Používa sa ako fungicíd pri liečbe farbiva a chorôb spôsobených kožnými hubami.
Používa sa tiež ako Emético (agent na zvratky) u ošípaných, psov a mačiek; ako antidiarrheal astringent pre teľatá a na kontrolu črevnej moniliázy v hydinovej a morskej trichomoniáze.
Ako doplnok kŕmenia zvierat
Sulfát medi sa používa ako doplnok vo veľmi malých množstvách na kŕmenie hovädzieho dobytka, ošípaných a hydiny. Slúži na liečbu nedostatku meďnatého u prežúvaní. V prípade ošípaných a vtákov sa používa ako stimulant rastu.
Môže vám slúžiť: chromatogramMeď bola identifikovaná ako nevyhnutná pre biosyntézu hemoglobínu u cicavcov, kardiovaskulárnu štruktúru, syntézu kostného kolagénu, enzýmových systémov a reprodukcie.
Ako je uvedené v predchádzajúcej časti, môže sa tiež dodávať ako lieky na kontrolu chorôb. Doplnenie a/alebo úroveň liekov sa však musia monitorovať opatrne.
 Vtáky z ohrady a ich vajcia môžu byť ovplyvnené prebytočným síranom medi vo svojej strave. Autor: pexels. Zdroj: Pixabay.
Vtáky z ohrady a ich vajcia môžu byť ovplyvnené prebytočným síranom medi vo svojej strave. Autor: pexels. Zdroj: Pixabay. Z určitého množstva, ktoré závisí od každého druhu, môže dôjsť.
Napríklad u kurčiat suplementácia 0,2% alebo viac znižuje ich požitie potravín s následným chudnutím, zníženou produkciou vajec a hrúbkou ich šupiek.
V poľnohospodárskych aplikáciách
V systémoch ekologickej výroby nie je dovolené používať syntetické fungicídy, akceptujú sa iba produkty meďnatiny a síry, ako je napríklad síran meďnatého.
Napríklad určité huby, ktoré útočia na rastliny jabĺk, ako napríklad Venturia inaequalis, sú eliminované touto zlúčeninou. Predpokladá sa, že prípadne ióny cu2+ Sú schopní vstúpiť do húb spór, denaturalizovať proteíny a blokovať niekoľko enzýmov.
 Sulfát medi slúži na boj proti húb, ktoré útočia na jablká. Algirdas na LT.Wikipedia / verejná doména. Zdroj: Wikimedia Commons.
Sulfát medi slúži na boj proti húb, ktoré útočia na jablká. Algirdas na LT.Wikipedia / verejná doména. Zdroj: Wikimedia Commons. Dôležitosť medi v rastlinách
Prvok medi je dôležitý vo fyziologických procesoch rastlín, ako je fotosyntéza, dýchanie a obrana proti antioxidantom. Nedostatok tohto prvku a jeho nadbytok vytvárajú reaktívne okysličené druhy, ktoré sú škodlivé pre molekuly a ich štruktúry.
Interval koncentrácie medi pre optimálny rast a vývoj rastlín je veľmi úzky.
Nepriaznivé účinky na poľnohospodárstvo
Ak sa tento produkt nadmerne používa pri poľnohospodárskych činnostiach, môže byť fytotoxický, spôsobiť vývoj predčasného ovocia a meniť jeho farbu.
Okrem toho sa meď akumuluje na zemi a je toxická pre mikroorganizmy a dážďovky. To je v rozpore s konceptom ekologického poľnohospodárstva.
 Aj keď cuso4 Používa sa v organickom poľnohospodárstve môže byť škodlivé pre zemské červy. Autor: Patricia Maine Degrave. Zdroj: Pixabay.
Aj keď cuso4 Používa sa v organickom poľnohospodárstve môže byť škodlivé pre zemské červy. Autor: Patricia Maine Degrave. Zdroj: Pixabay. Na chemické reakcie
Cuso4 Disndrous slúži ako katalyzátor pre niekoľko reakcií karbonylových organických zlúčenín s diolami alebo ich epoxidmi, tvoriacimi dioxolanmi alebo acetonidmi. Vďaka tejto zlúčenine môžu byť reakcie vykonané za mäkkých podmienok.
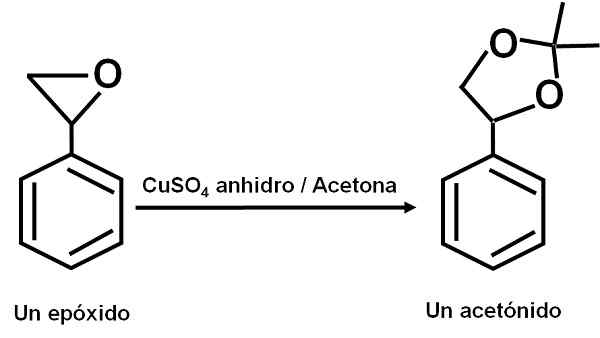 Príklad reakcie, pri ktorej cuso4 bezvodý pôsobí ako katalyzátor. Autor: Marilú Stea.
Príklad reakcie, pri ktorej cuso4 bezvodý pôsobí ako katalyzátor. Autor: Marilú Stea. Uvádza sa tiež, že jej katalytické pôsobenie umožňuje dehydratovať sekundárne, terciárne, benzyl a alilické alkoholy k zodpovedajúcim olefínom. Reakcia sa vykonáva veľmi jednoduchým spôsobom.
Môže vám slúžiť: anetolČistý alkohol sa zahrieva spolu s cusom4 bezvodý pri teplote 100-160 ° C po dobu 0,5-1,5 hodiny. Dehydratácia alkoholu a olefínu sa teda vyskytuje, čistá destiluje sa z reakčnej zmesi.
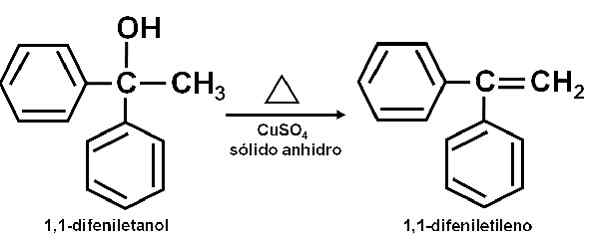 Dehydratácia alkoholu pre bezvodý sulfát medi (ii). Autor: Marilú Stea.
Dehydratácia alkoholu pre bezvodý sulfát medi (ii). Autor: Marilú Stea. Ako dehydratačný agent
Táto zlúčenina sa používa v chemických laboratóriách ako suší. Slúži na dehydratáciu organických tekutín, ako sú rozpúšťadlá. Absorbovať vodu tvoriacu zlúčeninu pentahydrátu Cuo4 •5H2Ani.
 Keď cuso4 Biela anhydro absorbuje vodu sa stáva zlúčeninou modrým pentahydrátom4.5H2Ani. Crystal Titan/CC By-SA (https: // creativecommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Keď cuso4 Biela anhydro absorbuje vodu sa stáva zlúčeninou modrým pentahydrátom4.5H2Ani. Crystal Titan/CC By-SA (https: // creativecommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Na zlepšenie polymérov
Cuso4 Anhydro sa používa na zlepšenie vlastností určitých polymérov a zároveň im umožňuje recyklovateľnosť.
Napríklad častice acetónovej zlúčeniny boli zmiešané s akrylonitril-butadiénovou gumou v špeciálnom mlyne, ktoré sa snažia vyrobiť častice cuso4 Byť veľmi malý.
Sulfát medi zlepšuje body polymérneho zväzu tvoriace zmes s vysokým odporom, tvrdosťou a prekvapujúcou flexibilitou.
V prerušených terapeutických aplikáciách
V minulosti sa použili roztoky sulfátu medi na umývanie žalúdka, keď niekto utrpel otravu bielym fosforom. Roztok sa však okamžite miešal, aby sa predišlo otravám medi.
Roztoky tejto zlúčeniny sa tiež používali spolu s ďalšími látkami na lokálne popáleniny v koži fosforom.
Niekedy slúžili v určitých formách výživy.
Určité vody pre ekzém, impeti a Intertrigo obsahovali Cuo4. Roztoky sa použili ako adstringent pri očných infekciách. Niekedy sa kryštály aplikovali priamo na popáleniny alebo vredy.
Všetky tieto aplikácie sa už nevykonávajú kvôli toxicite, ktorá môže vyvolať prebytočnú zlúčeninu.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Sírany medi. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Montag, J. a kol. (2006). Štúdia in vitro na Venturia inaequalis. J. Poľnohospodárstvo. Potravinárska chémia. 2006, 54, 893-899. Odkaz obnovený.Prubár.com.
- Holloway, a.C. a kol. (2011). Zvýšenie antimikrobiálnych aktivít celého a subfrakcionovaného bieleho čaju závislosťou z sulfátu medi (II) a vitamínu C proti Stafylococcus aureus; K mechanistickému prístupu. BMC Doplnok Alterna Med 11, 115 (2011). Zdroj: BMCComplementMedtherapies.biomedcentrálny.com.
- Sanz, a. a kol. (2018). Mechanizmus absorpcie medi Thalian Arabidopsis Vysokoúcnosť Copt Transporters. Protoplasma 256, 161-170 (2019). Odkaz obnovený.Prubár.com.
- Griminger, P. (1977). Vplyv síranu medi na výrobu vajec a hrúbku škrupiny. Hydina Science 56: 359-351, 1977. Uzdravené z akademického.Nakupovať.com.
- Hanzlik, r.P. A Leinwetter, m. (1978). Reakcia epoxidov a karbonylových zlúčenín katalyzovaných bezvodým síranom medi. J. Orgán. Chem., Zvuk.43, nie.3, 1978. Získané z krčiem.ACS.orgán.
- Okonkwo, a.C. a kol. (1979). Požiadavka medi detských ošípaných kŕmených purifikovanou stravou. The Journal of Nutrition, Zväzok 109, vydanie 6, jún 1979, strany 939-948. Uzdravené z akademického.Nakupovať.com.
- Hoffman, R.Vložka. a kol. (1979). Sulfát bezvodej medi (II): Efektívnosť. J. Orgán. Chem., 1980, 45, 917-919. Získané z krčiem.ACS.orgán.
- Shao, C. a kol. (2018). Vylepšená pevnosť v ťahu akrylonitril-butadiénových guma/bezvodých kompozitov sulfátu medi pripravené koordinačným zosieťovaním. Polym. Býk. 76, 1435-1452 (2019). Odkaz obnovený.Prubár.com.
- Betts, J.W. a kol. (2018). Nové antibakteriály: alternatívy k tradičným antibiotikám. Meď. V pokroku v mikrobiálnej fyziológii. Zotavené z vedeckých pracovníkov.com
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Stránky Google. Vyrábať bezvodý síran meďnatého. V paradoxnej domácej chémii. Získané z stránok.Riadenie.com.

