História selénu, vlastnosti, štruktúra, získanie, použitie

- 2105
- 137
- Alan Milota
On selén Je to net -metalická chemikália, ktorá patrí do skupiny 16 periodickej tabuľky a je reprezentovaná symbolom je. Tento prvok má stredné vlastnosti medzi Sulphur a Telurio, ktoré sú členmi tej istej skupiny.
Selén objavil v roku 1817 Jöhs J. Berzelius a John G. Gahn, ktorý odparil pyrit, pozoroval červený zvyšok (nižší obrázok). Najprv ho zamieňali s Teluriom, ale potom si uvedomili, že čelia novému prvku.
 Fľaša s amorfným červeným selénom, najznámejšie pre tento prvok. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Fľaša s amorfným červeným selénom, najznámejšie pre tento prvok. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Berzelius nazval nový prvok ako selén, založený na mene „Selene“, čo znamená „bohyňu Moon“. Selén je nevyhnutnou stopou pre rastliny a zvieratá, hoci vo vysokých koncentráciách je toxickým prvkom.
Selén má tri hlavné alotropné formy: červená, čierna a šedá. Ten má vlastnosť modifikácie svojej elektrickej vodivosti na základe intenzity svetla, ktoré ho vyžaruje (fotokonduktor), takže má veľa aplikácií.
Selén je široko distribuovaný v zemskej kôre, avšak minerály, ktoré ju obsahujú.
Získava sa hlavne ako sekundárny produkt procesu rafinácie elektrolýzou medi. Selén sa hromadí v slizu, ktorý je v anóde elektrolýznych buniek.
Ľudské bytosti majú okolo 25 seleenoproteínov, z ktorých niektoré spĺňajú antioxidačné pôsobenie a kontrolujú generovanie voľných radikálov. Existujú aj seléniové aminokyseliny, ako je selenomekcionár a selenocysteín.
[TOC]
História
Prvé pozorovanie
Alchymista Arnold z Villanova mohol pozorovať selén v roku 1230. Toto bolo vytvorené v medicíne v Parížskom Sorbonne a bolo dokonca aj doktorom pápeža Clemente v.
Villanova vo svojej knihe Rosarium Philosophorum Opíšte červenú síru alebo „sulfurový recoule“, ktorý zostal v peci po odparovaní síry. Táto červená síra mohla byť alotropický selén.
Objavenie
V roku 1817 objavili Jöhs Jakob Berzelius a John Gottlieb Gahn selén v chemickej elektrárni na výrobu kyseliny sírovej, neďaleko Gripsholmu, Švédsko. Surovina na vypracovanie kyseliny bola pyrit, ktorý extrahoval z bane Falun.
Berzelius bol zasiahnutý existenciou červeného zvyšku, ktorý zostal v hlavnej nádobe po spálení síry.
Berzelius a Gahn tiež poznamenali, že červený zvyšok mal silnú vôňu pikantnej reďkovky, podobne ako vecia, ktorú predstavil Telurio. Dôvod, prečo, napísal svojmu priateľovi Marct, že veria, že pozorovaný ložisko je zlúčenina v Telurio.
Blelius však naďalej analyzoval uložený materiál spaľovaním pyritu a prehodnotil, že Telurio nebol nájdený vo Falun. Vo februári 1818 dospel k záveru, že objavil nový prvok.
Pôvod vášho mena
Berzelius poukázal na to, že nový prvok bol kombináciou síry a Telurio a že podobnosť Telurio s novým prvkom mu dala príležitosť vymenovať novú látku selénu.
Berzelius vysvetlil, že „Tellus“ znamená bohyňu Zeme. Martin Klapor v roku 1799 umiestnil toto meno Telurio a napísal: „Žiadny prvok sa nazýva iba týmto spôsobom. Muselo sa to urobiť!„.
Vzhľadom na podobnosť Telurio s novou látkou to Berzelius nazval slovom selén, odvodeným z gréckeho slova „selene“, čo znamená „bohyňu mesiaca“.
Vývoj vašich aplikácií
V roku 1873 Willoughby Smith zistil, že elektrická vodivosť predstavená selénom závisela od svetla, ktoré ho vyžarovalo. Táto vlastnosť umožnila seléniu mať početné aplikácie.
Alexander Graham Bell v roku 1979 použil selén vo svojom fotofóne. Selén vytvára elektrický prúd úmerný intenzite svetla, ktoré ho osvetľuje, pri použití meracích metrov, bezpečnostných mechanizmov na otváranie a zatváranie dverí atď.
Použitie usmerňovačov selénu v elektronike sa začalo od 30. rokov 20. storočia s mnohými komerčnými aplikáciami. V sedemdesiatych rokoch bol nahradený do usmerňovačov na kremík.
V roku 1957 sa zistilo, že selén bol podstatným prvkom životnosti cicavcov, pretože bol prítomný v enzýmoch, ktoré chránia pred reaktívnym kyslíkom a voľnými radikálmi. Okrem toho sa objavila existencia aminokyselín, ako je selenomferetín.
Fyzikálne a chemické vlastnosti
Vzhľad
Existuje niekoľko alotropov pre selén, ich fyzický vzhľad sa líši. Zvyčajne sa prezentuje ako červenkastá pevná látka vo forme prachu.
Štandardná hmotnosť
78 971 u
Atómové číslo (z)
3. 4
Bod topenia
221 ° C
Bod varu
685 ° C
Hustota
Hustota selénu sa líši v závislosti od toho, ktorý alotropický alebo polymorf sa uvažuje. Niektoré z jeho určených hustoty pri izbovej teplote sú:
Šedá: 4 819 g/cm3
Alfa: 4,39 g/cm3
Sklovím: 4,28 g/cm3
Kvapalný stav (bod topenia): 3,99 g/cm3
Fúzne teplo
Šedá: 6,69 kj/mol
Odparovanie
95,48 kj/mol
Molárna kalikára
25 363 J/(mol · k)
Oxidácia
Selén môže byť spojený vo svojich zlúčeninách, ktoré prejavujú nasledujúce čísla alebo oxidačné stavy: -2, -1, +1, +2, +3, +4, +5, +6. Medzi nimi je najdôležitejšie -2 (2-), +4 (viem4+) a +6 (viem6+).
Môže vám slúžiť: jednoduchý mikroskopNapríklad v SEO2 Selén má oxidačné číslo +4; to znamená, že sa predpokladá existencia katiónu4+ (On4+Ani22-). Podobné SEO3 Selén má +6 oxidačné číslo (i6+Ani32-).
V vodíkovom seleniuro, h2SE, selén má oxidačné číslo -2; To je opäť existencia iónu alebo aniónu2- (H2+On2-). Je to preto, že selén je viac elektronegatívny ako vodík.
Elektronegativita
2.55 v Pauling Scale.
Ionizačná energia
-Prvé: 941 kj/mol.
-Po druhé: 2.045 kJ/mol.
-Tretie: 2.973,7 kJ/mol.
Magnetický poriadok
Diamagnetický.
Tvrdosť
2.0 na stupnici Mohs.
Izotopy
Existuje päť prírodných a stabilných izotopov selénu, ktoré sú uvedené nižšie s ich príslušnými množstvami:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Alotropia
 Čierna fľaša potiahnutá tenkým filmom selénu šedej. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Čierna fľaša potiahnutá tenkým filmom selénu šedej. Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Selén pripravený v chemických reakciách je tehlový červený amorfný prášok, ktorý, keď je založený sklovitý čierny tvar, podobný účtom Rosario (vynikajúci obraz). Black Selén je krehký a lesklý pevný.
Okrem toho je čierny selén mierne rozpustný v sulfide uhlíka. Keď sa tento roztok zahrieva pri 180 ° C, šedý selén zráža, jeho najstabilnejší a najhustejší alotropnejší.
Šedý selén je odolný voči oxidácii a je inertný na pôsobenie neoxidujúcich kyselín. Hlavnou vlastnosťou tohto selénu je jeho fotokonductivita. Osvetlenie zvyšuje svoju elektrickú vodivosť faktorom 10 až 15 -krát.
Reaktivita
Selén vo svojich zlúčeninách existuje v oxidačných stavoch -2, +4 a +6. Prejavuje jasnú tendenciu tvoriť kyseliny vo vyšších oxidačných stavoch. Zlúčeniny, ktoré majú selén s oxidačným stavom -2, sa nazývajú seleniuros (2-).
Vodíková reakcia
Selén reaguje s vodíkom za vzniku vodíka seleniuro (h2Se), bezfarebný, horľavý a páchnuci plyn.
Reakcia kyslíka
Selén horí tak, že emituje modrý plameň a vytvorením oxidu selénu:
On8 (s) + 8 o2 => 8 SEO2 (S)
Oxid selénu je polymérna, biela a pevná látka. Jeho hydratácia produkuje kyselinu selenóznu (H2SEO3). Selén tiež tvorí trioxid selénu (SEO3), Analogické s sírou (SO3).
Reakcia s halogénmi
Selén reaguje s fluoridom za vzniku hexafluóru selénu:
On8 (s) +24 f2 (g) => 8 SEF6 (L)
Selén reaguje s chlórom a brómom za vzniku dichloridu a dysilénium dibromure:
On8 (s) +4 Cl2 => 4 SE2Cl2
On8 (s) +4 br2 => 4 SE2Br2
Selén môže tiež tvoriť SEF4 a sekret4.
Na druhej strane, selén tvorí zlúčeniny, v ktorých sa atóm selénu spája s jedným z halogénu a druhým kyslíkom. Dôležitým príkladom je oxychlorid selénu (SEO2Cl2), S selénom v oxidácii +6, mimoriadne výkonné rozpúšťadlo.
Reakcia s kovmi
Selén reaguje s kovmi za vzniku hliníka, kadmia a sodný seleniuros. Chemikália nižšie zodpovedá tvorbe hliníka seleniuro:
3 se8 + 16 al => 8 až2On3
Selenitas
Soliky selénu známe ako selenitas; Napríklad: strieborný selenit (AG2SEO3) a selenit sodný (NA2SEO3). Tento názov sa v literárnom kontexte použil na označenie obyvateľov Mesiaca: Selenitas.
Kyseliny
Najdôležitejšou kyselinou selénom je kyselina tesnená (H2SEO4). Je rovnako silný ako kyselina sírová a ľahšie sa zníži.
Elektronická štruktúra a konfigurácia
- Selén a jeho odkazy
Selén má šesť elektrónov vo Valencii, a preto sa nachádza v skupine 16, rovnako ako kyslík a síra. Podľa ich elektronickej konfigurácie sa týchto šesť elektrónov nachádza na orbitáloch 4S a 4P:
[AR] 3D10 4s2 4p4
Preto, podobne ako síra, vytvorí dve kovalentné väzby na dokončenie svojho oktetu Valencie; Aj keď má dostupnosť svojich 4D orbitálov na prepojenie viac ako dvoch atómov. Trtestvá prístupu k atómom selénu a tvoria dve kovalentné väzby: SE-SE-SE.
Selén s väčšou atómovou hmotnosťou má prirodzenú tendenciu vytvárať štruktúry riadené kovalentnými dlhopismi; Namiesto toho, aby boli usporiadané ako diatomické molekuly2, Se = se, analogické k O2, O = O.
- Prstene alebo reťaze
Medzi molekulárnymi štruktúrami prijatými atómami selénu sa dajú spomenúť vo všeobecnosti: krúžky alebo reťazce. Všimnite si, že v hypotetickom prípade SE3, Atómy sú stále potrebné na koncoch; Preto sa musia postupne spojiť s inými atómami.
Najbežnejšie prstene sú prstene ôsmich členov alebo atómov selénu:8 (Selenitská koruna). Prečo osem? Pretože čím menší je prsteň, tým väčšie bude napätie trpieť; To znamená, že uhly ich odkazov sa líšia od prírodných hodnôt stanovených ich hybridizáciou SP3 (podobné ako v prípade cykloalcanos).
Môže vám slúžiť: Pascal striekačkaExistuje osem atómov, oddelenie medzi se-atómami je dostatočné na to, aby ich prepojenia boli „uvoľnené“ a nie „zložené“; Aj keď uhol jeho odkazov je 105,7 a nie 109.5. Na druhej strane môžu byť menšie krúžky: i6 a7.
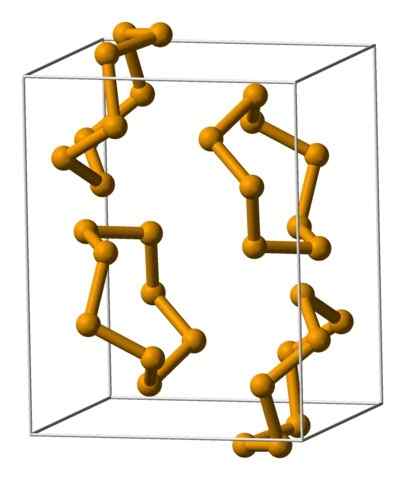 Jednotky selénu Analeres zastúpené s modelom guľôčok a tyčí. Zdroj: Benjah-Bmm27 [verejná doména].
Jednotky selénu Analeres zastúpené s modelom guľôčok a tyčí. Zdroj: Benjah-Bmm27 [verejná doména]. Na hornom obrázku sú zobrazené jednotky Analeres8. Všimnite si podobnosť, ktorú majú s korunkami síry; Iba oni sú väčšie a ťažké.
Okrem krúžkov môžu byť atómy selénu usporiadané aj v špirálových reťazcoch (premýšľajte na slimákových schodoch):
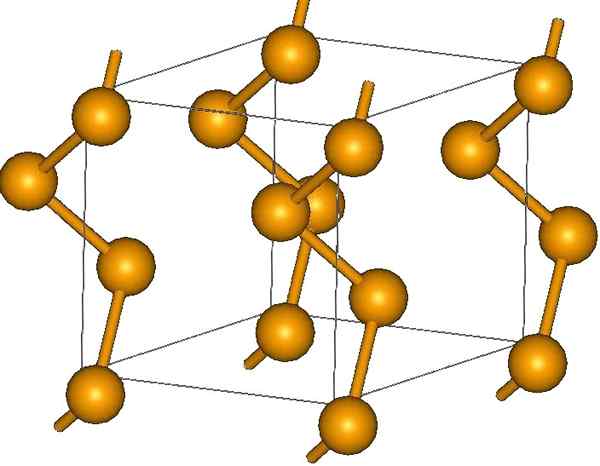 Špirálové reťazce selénu. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Špirálové reťazce selénu. Zdroj: Materialscientist v anglickej Wikipédii [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Na svojich koncoch môžu byť dvojité koncové odkazy (-se = SE) alebo sú krúžky8.
- Alotropy
Berúc do úvahy, že môžu existovať špirálové krúžky alebo reťazce selénu a že ich rozmery sa môžu líšiť aj v závislosti od počtu atómov, ktoré obsahujú, potom je zrejmé, že pre tento prvok je viac ako jeden alotropický; Toto sú čisté tuhé látky selénu, ale s rôznymi molekulárnymi štruktúrami.
Červené selény
Medzi najvýznamnejšími alotropmi selénu máme červenú farbu, ktorá sa dá prezentovať ako amorfný prach alebo ako monoklinické a polymorfné kryštály (pozri obrázok krúžkov sú8).
V amorfnom červenom seléne sú štruktúry nepokojne, bez zjavných vzorov; Zatiaľ čo vo objektívu, krúžky stanovujú monoklinickú štruktúru. Kryštalický červený selén je polymorfný, má tri fázy: a, β a y, ktoré sa líšia v ich hustote.
Čierny selén
Štruktúra čierneho selénu tiež pozostáva z krúžkov; Ale nie osem členov, ale mnoho ďalších, sú tu kruhy tisíc atómov (1 000). Potom sa hovorí, že jej štruktúra je zložitá a pozostáva z polymérnych krúžkov; nejaké väčšie alebo malé ako iné.
Ak existujú polymérne krúžky rôznych veľkostí, je ťažké čakať na vytvorenie štrukturálneho poriadku; Takže čierne selén je tiež amorfný, ale na rozdiel od vyššie uvedeného červenkastého prachu má sklovité kontexty, hoci je krehký.
Šedá selén
A nakoniec, z najjednoduchších alotropov selénu je šedá, ktorá vyniká nad ostatnými tým, že je najstabilnejšia za normálnych podmienok a má tiež kovový vzhľad.
Ich kryštály môžu byť hexagonálne alebo trigonálne, založené londýnskymi disperznými silami medzi ich polymérnymi špirálovými reťazcami (vynikajúci obraz). Uhol jeho odkazov je 130,1 °, čo naznačuje pozitívnu odchýlku tetraedrálneho prostredia (s uhlami 109,5 °).
Preto špirálové reťazce selénu vyvolávajú dojem, že sú „otvorené“. Prostredníctvom objasnenia sú v tejto štruktúre konfrontované atómy, takže teoreticky musí existovať väčšie prekrývanie svojich orbitálov, aby sa vytvorili vodičské pásma.
Teplo so zvyšovaním molekulárnych vibrácií poškodzuje tieto pásy, keď sú reťazce nepokojné; Zatiaľ čo energia fotónu priamo ovplyvňuje elektróny, vzrušuje ich a podporuje ich transakcie. Z tejto vízie je „ľahké“ predstaviť si fotokonductivitu pre selén šedú.
Kde je a výroba
Aj keď je široko distribuovaný, selén je zriedkavý prvok. Je v pôvodnom stave spojenom s síry a minerály, ako je eucairita (cuagse), cloustalita (PBSE), naumanit (AG AG2Se) a Crookesit [(cutiag)2On].
Selén sa nachádza ako nečistota, ktorá nahrádza síru v malej časti kovových sírových minerálov; ako je meď, olovo, striebro atď.
Existujú pôdy, v ktorých selén existuje v rozpustnej forme selenátu. Tieto sú prenášané vodami dažďov do riek a odtiaľ smerom k oceánu.
Niektoré rastliny sú schopné absorbovať a koncentrovať selén. Napríklad šálka orechov v Brazílii obsahuje 544 µg selénu, čo je suma zodpovedá 777% z množstva odporúčaného selénu odporúčaného denne.
V živých bytostiach sa selén nachádza v niektorých aminokyselinách, ako napríklad: selenometreín, selenocysteín a metylselenocysteín. Selenocysteín a selenit sa redukujú na vodík seleniuro.
Elektrolýza medi
Neexistuje žiadne ťažobné vykorisťovanie selénu. Väčšina častí sa získa ako sekundárny produkt procesu rafinácie elektrolýzou medi, ktorá je v bahne, ktorá sa hromadí v anóde.
Prvý krok pozostáva z výroby oxidu selénu. Na tento. Potom sa pridá oxid selénu a je okyslený, aby sa vytvorila kyselina selenová.
Nakoniec je to kyselina selenózna kyselina s oxidom siričitého, aby sa vytvorila jeho redukcia a získala elementárny selén.
V inej metóde v zmesi bahna a bahna vytvoreného pri výrobe kyseliny sírovej sa získa Ilprel Red Selén, ktorý sa rozpúšťa v kyseline sírovej.
Potom sa vytvoria kyselina selenary a kyselina selénová. Táto selenózna kyselina dostáva rovnaké ošetrenie ako predchádzajúca metóda.
Môže sa tiež použiť chlór, ktorý pôsobí na kovové seleniurské na výrobu prchavých zlúčenín chlórovaných selénom; ako: Ja viem2Cl2, Utajenie4, Utajenie2 a seocl2.
Môže vám slúžiť: chemická úroveňTieto zlúčeniny sa v procese vykonávanom vo vode stávajú kyselinou Selenous, ktorá je ošetrená oxidom siričitého na uvoľnenie selénu.
Biologický dokument
Nedostatok
Selén je nevyhnutnou stopou pre rastliny a zvieratá, ktorých nedostatok u ľudí spôsobil vážne poruchy, ako je Keshanova choroba; Ochorenie charakterizované poškodením myokardu.
Nedostatok selénu je navyše spojený s mužskou neplodnosťou a môže hrať úlohu pri Kašin-Beckovej chorobe, druhu osteoartritídy. Podobne sa pozoroval nedostatok selénu pri reumatoidnej artritíde.
Enzymatický kofaktor
Selén je súčasťou enzýmov s antioxidačným účinkom, ako je glutačná peroxidáza a tioresodoxín reduktáza, ktorá pôsobí pri eliminácii látok reaktívnym kyslíkom.
Okrem toho je selén kofaktorom hormónov štítnej žľazy desiodinázy. Tieto enzýmy sú dôležité pri regulácii fungovania hormónov štítnej žľazy.
Použitie selénu bolo indikované pri liečbe Hasimotovej choroby, autoimunitného ochorenia s tvorbou protilátok proti bunkám štítnej žľazy.
Selén sa tiež používa na zníženie toxických účinkov ortuti, pretože niektoré z jeho účinkov sa vykonávajú na antioxidačné enzýmy závislé od selénu.
Proteíny a aminokyseliny
Muž má asi 25 seleenoproteínov, ktoré vyvíjajú antioxidačný účinok na ochranu pred oxidačným stresom, iniciované nadbytkom reaktívnych druhov kyslíka (ROS) a reaktívnych druhov dusíka (NI).
Prítomnosť aminokyselín Selenometytheocín a selenocysteín u ľudí bola zistená. Selenomectionine sa používa ako doplnok výživy pri liečbe stavov nedostatku selénu.
Riziká
Vysoká koncentrácia tela selénu môže mať početné škodlivé účinky na zdravie, počnúc krehkými vlasmi a krehkými klincami, na vyrážky na koži, teplo, opuchy kože a silnú bolesť.
Pri riešení selénu v kontakte s očami môžu ľudia vyjadriť horlivosť, podráždenie a roztrhnutie. Medzitým môže predĺžená expozícia dymu s vysokým obsahom selénu spôsobiť pľúcny edém, cesnakový dych a bronchitídu.
Okrem toho môže osoba zažiť pneumonitídu, nevoľnosť, zimnicu, horúčku, bolesť hrdla, hnačky a hepatomegália.
Selén môže interagovať s inými liekmi a doplnkami výživy, ako sú antacidy, antineoplastické lieky, kortikosteroidy, niacín a tablety na kontrolu pôrodnosti.
Selén bol spojený so zvýšeným rizikom kontrakcie rakoviny kože. V štúdii Národného inštitútu pre rakovinu sa zdôraznilo, že muži s vysokou koncentráciou tela selénu mali dvakrát ako pravdepodobnosť utrpenia agresívnou rakovinou prostaty.
Štúdia naznačuje, že denný príjem 200 µg selénu sa zvyšuje o 50% možnosť vyvinúť cukrovku typu II.
Žiadosti
Kozmetika
Sulfid selénu sa používa pri liečbe seborrhea, ako aj mastných alebo lupín.
Lekári
Používa sa ako alternatívny liek pri liečbe Hasimotovej choroby, autoimunitného ochorenia štítnej žľazy.
Selén znižuje toxicitu ortuti, ktorej jednou z jej toxických aktivít sa vyvíja na enzýmy deoxidantov, ktoré používajú selén ako kofaktor.
Elektrolýza mangánu
Použitie oxidu selénu pri elektrolýze mangánu značne znižuje náklady na techniku, pretože elektrická spotreba klesá.
Pigment
Selén sa používa ako pigment v obrazoch, plastoch, keramike a skle. V závislosti od selénu sa používa farba skla mení od tmavo červenej po ľahkú oranžovú farbu.
Fotokonduktívny
Vzhľadom na vlastnosť šedého selénu zmeny svojej elektrickej vodivosti v závislosti od intenzity svetla, ktoré ho vyžaruje, sa selén použil vo fotokopieroch, fotokipároch, fotometre a solárnych článkoch.
Použitie selénu vo fotokopieroch bolo jednou z hlavných aplikácií selénu; Ale vzhľad organických fotokonductorov znižuje jeho použitie.
Kryštály
Selén sa používa na sfarbenie skla v dôsledku prítomnosti železa, ktorá vytvára zelené alebo žlté sfarbenie. Okrem toho umožňuje červené sfarbenie skla v závislosti od použitia, ktoré chcete dať.
Vulkanizácia
Dieténio dietenium sa používa ako vulkanizujúce činidlo gumových výrobkov.
Zliatiny
Selén sa používa v kombinácii s bizmutom v mosadze, aby sa nahradil olovo; Veľmi toxický prvok, ktorý znížil jeho použitie v dôsledku odporúčaní zdravotníckych agentúr.
Selén sa pridáva k nízkym koncentráciám do zliatiny ocele a medi, aby sa zlepšilo ľahké používanie týchto kovov.
Usmerňovače
Usmerňovače selénu sa začali používať v roku 1933 až do 70. rokov 20. storočia, keď boli nahradené kremíkom s nízkymi nákladmi a vyššou kvalitou.
Odkazy
- Kráľovský austrálsky chemický inštitút. (2011). Selén. [PDF]. Získané z: Raci.orgán.Au
- Wikipedia. (2019). Selén. Zdroj: In.Wikipedia.orgán
- Sato kentaro. (s.F.). Nové Allotropy prvkov hlavnej skupiny. [PDF]. Zdroj: tcichemikálie.com
- DR. Cesto. (2019). Fakty prvkov selénu. Chemickolák. Získané z: Chemicool.com
- Robert C. Zapálený. (28. augusta 2019). Selén. Encyclopædia Britannica. Získané z: Britannica.com
- Marques Miguel. (s.F.). Selén. Získané z: Nautilus.Fis.Uc.Pt
- HelMestine, Anne Marie, PH.D. (3. júla 2019). Selénové fakty. Zotavené z: Thoughtco.com
- Šošovica B. Vložka. (2019). Tabuľka doby: selén. Získané z: Lentech.com
- Tinggi u. (2008). Selén: Jeho úloha antioxidantu v ľudskom zdraví. Zdravie životného prostredia a prevencia medicíny, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Úrad pre výživové doplnky. (9. júla 2019). Selén: Fakty pre zdravotníckych odborníkov. Národný inštitút zdravia. Zdroj: SDG.Odplaziť.NIH.Vláda

