Diazonium soli

- 4625
- 137
- Adrián Fajnor
Vysvetľujeme, čo sú diazonium soli, ako sa tvoria ich vlastnosti a aplikácie
Čo sú diazonium soli?
Ten Diazonium soli Sú to organické zlúčeniny, v ktorých existujú iónové interakcie medzi skupinou AZO (-n2+) A anión x- (CL-, F-, Chvály3Coo-, atď.). Jeho všeobecný chemický vzorec je RN2+X-, a v tomto môže byť bočný reťazec R dobre alifatickou skupinou alebo arylovou skupinou; to znamená aromatický prsteň.
Na dolnom obrázku je reprezentovaná štruktúra iónu areodiazonium. Modré gule zodpovedajú skupine Azo, zatiaľ čo čierna a biela tvoria aromatický kruh fenylovej skupiny. AZ+≡n).

Existujú však rezonančné štruktúry, ktoré delokalizujú toto pozitívne zaťaženie, napríklad v atóme susedného dusíka: -n = n+. To vznikne, keď je niekoľko elektrónov, ktoré tvoria odkaz, nasmerovaný na atóm dusíka vľavo.
Podobne je toto kladné zaťaženie schopné demokovať prostredníctvom systému PI aromatického kruhu. V dôsledku toho sú aromatické diazóniové soli stabilnejšie ako alifatické, pretože pozitívne zaťaženie sa nemôže demokovať pozdĺž uhlíkového reťazca (CH3, Chvály2Chvály3, atď.).
Výcvik
Tieto soli odvodzujú z reakcie primárnej aminy s kyslou zmesou dusitanu sodného (nano2).
Sekundárne amíny (r2NH) a terciárne (r3N) iné produkty dusíka, ako je N-nitrosoamín (ktoré sú žltkasté oleje), amínové soli (r3HN+X-) a n-nitrozóniové zlúčeniny.
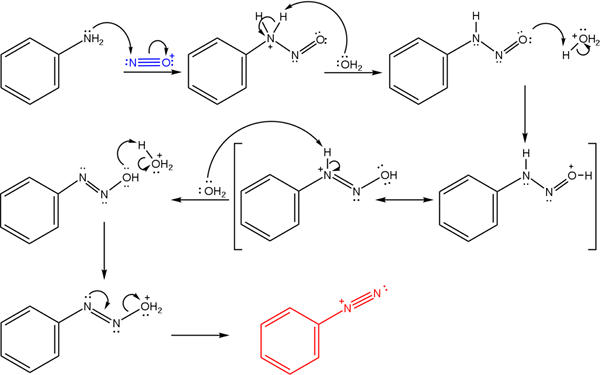
Vynikajúci obraz ilustruje mechanizmus, ktorým sa riadi tvorba diazóniových solí alebo tiež známa ako diazotizačná reakcia.
Môže vám slúžiť: Chrome (Cr)Reakcia začína fenylamínom (AR-NH2), ktorý vykonáva nukleofilný útok na atóm katiónu nitrozóniového katiónu (nie+). Táto katión je produkovaný nano zmesou2/Hx, kde x je zvyčajne cl; to znamená, HCI.
Tvorba katiónu Nitrosónium uvoľňuje vodu uprostred, čo chytí pozitívne naložený dusíkový protón.
Potom rovnaká molekula vody (alebo iné kyslé druhy odlišné od h3Ani+) poskytnúť protón do kyslíka, ktorý demokratuje pozitívnu záťaž v menej elektronického atómu dusíka).
Teraz je voda opäť nechránená na dusík, potom produkuje molekulu diazohydroxidu (antepenultimácia sekvencie).
Pretože médium je kyslé, diazohydroxid trpí dehydratáciou OH skupiny; Na pôsobenie proti elektronickému neobsadeniu, voľný krútiaci moment trojitého spojenia skupiny AZO.
Týmto spôsobom zostáva na konci mechanizmu chlorid Bencenodiazonium v roztoku (C6H5N2+Cl-).
Vlastnosti
Všeobecne sú diazóniové soli bezfarebné a kryštalické, rozpustné a stabilné pri nízkych teplotách (menej ako 5 ° C).
Niektoré z týchto solí sú tak citlivé na mechanický dopad, že ich fyzická manipulácia môže odpáliť. Nakoniec reagujú s vodou za vzniku fenolov.
Výtlakové reakcie
Diazonium soli sú potenciálny molekulárny dusík, ktorého tvorba je spoločným menovateľom reakcií na vytesnenie. V týchto druhoch X vytlačí nestabilnú skupinu Azo, ktorá unikla ako n2g).
Reakcia piesku
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + CUCN => ARCN + N2 + Cu+
Gattermanova reakcia
RNA2+ + Cux => Arx + n2 + Cu+
Na rozdiel od Sandmeyerovej reakcie má Gattermanova reakcia namiesto jeho halogenidu kovovú meď; to znamená, že Cux sa generuje In situ.
Schiemannská reakcia
[RNA2+] Bf4- => Arf + bf3 + N2
Môže vám slúžiť: Ketóny: typy, vlastnosti, nomenklatúra, použitia, príkladySchiemannova reakcia sa vyznačuje tepelným rozkladom benzónium fluorobratul.
Reakcia Gomberg Bachmann
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + Hcl
Ďalšie posuny
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Po2 + H2O => c6H6 + N2 + H3Po3 + Hcl
RNA2+ + H2O => AROH + N2 + H+
RNA2+ + Pečiatka2 => Arno2 + N2 + Cu+
Redoxné reakcie
Diazonium soli sa môžu redukovať na arilhydrazíny s použitím zmesi CNCL2/Hcl:
RNA2+ => Arnhnh2
Môžu sa tiež redukovať na arilamíny v silnejších redukciách so Zn/HCl:
RNA2+ => Rnah2 + NH4Cl
Fotochemický rozklad
[RNA2+] X- => Arx + n2
Diazonium soli sú citlivé na rozklad pomocou výskytu ultrafialového žiarenia alebo pri veľmi blízkych vlnových dĺžkach.
Reakcie na spojenie s azo
RNA2+ + Ar'H → RNA2Ar ' + h+
Tieto reakcie sú pravdepodobne najužitočnejšími a najuniverzálnejšími diazónskymi soľami. Tieto soli sú slabé elektrofily (kruh presúva pozitívne zaťaženie skupiny AZO). Aby reagoval s aromatickými zlúčeninami, musia byť negatívne nabité, a tak spôsobujú zlúčeniny AZOS.
Reakcia prechádza s účinným výkonom medzi pH 5 a 7. Pri kyslom pH je spojenie nižšie, pretože protóny skupiny AZO, čo znemožňuje útok negatívneho kruhu.
Tiež pri základnom pH (väčšieho ako 10) diazonium soli reaguje s OH- Na výrobu diazohydroxidu, ktorý je relatívne inertný.
Štruktúry tohto typu organických zlúčenín majú veľmi stabilný konjugovaný PI systém, ktorého elektróny absorbujú a vyžarujú žiarenie vo viditeľnom spektre.
V dôsledku toho sa azo zlúčeniny charakterizujú farebnými. Kvôli tejto nehnuteľnosti sa tiež nazývali azoické farby.
Môže vám slúžiť: molarita: koncentrácia, jednotky, výpočet, cvičenia
Vynikajúci obrázok ilustruje koncept spojky s oranžovým metylom ako príklad. Uprostred svojej štruktúry je možné pozorovať skupinu AZO, ktorá slúži ako konektor týchto dvoch aromatických krúžkov.
Ktorý z týchto dvoch krúžkov bol elektrofík na začiatku spojky? Ten vpravo, pretože skupina sulfonátov (-so3) Odstráňte hustotu elektronického krúžku, vďaka čomu je ešte viac elektrofily.
Žiadosti

Jednou z jeho najkomerčnejších aplikácií je výroba farbív a pigmentov, ktoré pokrývajú textilný priemysel v tkaninách. Tieto azoické zlúčeniny sú ukotvené na špecifických molekulárnych miestach polyméru, umierajú farby.
Vďaka svojmu fotolitickému rozkladu sa (menej ako predtým) používa pri reprodukcii dokumentov. Ako? Papierové oblasti pokryté špeciálnym plastom sú odstránené a potom sa aplikuje základné roztok fenolu, vyfarbenie písmen alebo modrého dizajnu.
Pri organickej syntéze sa používajú ako východiskové body pre mnoho aromatických derivátov.
Nakoniec majú aplikácie v oblasti inteligentných materiálov. V nich je spojený povrch (napríklad zlato), čo mu umožňuje dať chemickú reakciu na vonkajšie fyzikálne podnety.

