Charakteristiky, štruktúra, funkcie
- 3704
- 127
- MUDr. Miloslav Habšuda
Ten Sakera, Je tiež známy ako komplex Tabera-izomaltázy, je to membránsky enzymatický komplex s aktivitou a-glykozylázy patriacou skupine komplexných hydroláz (pozostávajúcich z glykozidáz a peptidáz).
Je prítomný v črevných mikrovingoch mnohých pozemných zvierat, ako sú cicavce, vtáky a plazy. Podľa rôznych bibliografických zdrojov sú ďalšie akceptované názvy tohto enzýmu oligo-1,6-glukozidáza, a-metylglukozidáza, izomaltázy a oligosacharid a-1,6-glukozidáza.
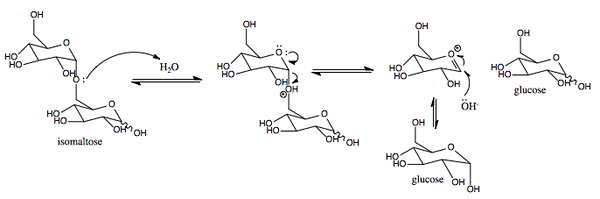
 Grafické znázornenie mechanizmu pôsobenia Sacas.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
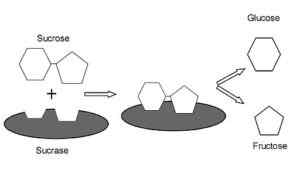
Grafické znázornenie mechanizmu pôsobenia Sacas.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Je to enzým s aktivitou podobnou invertovi sa zistil v rastlinách a mikroorganizmoch. Jej primárnou funkciou je hydrolyzovať glukozidickú väzbu medzi monosacharidmi (glukóza a fruktóza), ktorá tvorí sacharózu požitú potravou.
Má veľmi dôležité tráviace funkcie, pretože sacharóza sa nedá transportovať ako disacharid do črevných buniek, a preto jej hydrolýza umožňuje črevnú absorpciu jeho zložkových monosacharidov.
Syntéza a aktivita nápadníka-izomaltázy v črevných bunkách zvierat je regulovaná na mnohých úrovniach: počas transkripcie a translácie, počas glykozylácie a tiež počas jej posttranslačného spracovania.
Ak sa niektorý z týchto udalostí zlyhá alebo sa vyskytne nejaký typ mutácie v géne, ktorý ho kóduje, u ľudí existuje patologický stav známy ako syndróm deficitu sacharózy, ktorý súvisí s nemožnosťou metabolizácie disacharidov.
[TOC]
Charakteristika
Disacharidy, ktoré slúžia ako substrát pre cicavce u cicavcov. Dôvodom je skutočnosť, že SACA nielen hydroluje glukozidné väzby sacharózy, ale aj a-1,4 väzby maltózy a maltotriosa a ďalšie oligosacharidy.
Polovičný život z toho istého sa pohybuje medzi 4 a 16 hodinami, takže črevné bunky investujú veľa.
Môže vám slúžiť: čo je to Crention? (Biológia)Syntéza
Rovnako ako väčšina komplexných hydrolázových enzýmov, aj vreckáče (samovníková-izomaltázy alebo áno) je syntetizovaný glykoproteín v bunkách kefových okrajov, ako je napríklad polypeptidový prekurzor označený pro-IF-IF.
Táto molekula prekurzorov sa transportuje do apikálneho povrchu buniek a enzymaticky sa spracováva pankreatickými proteázami, ktoré ju rozdeľujú na dve rôzne podjednotky: izomaltázová podjednotka a podjednotka podjednotiek podjednotiek.
Izomaltázová podjednotka zodpovedá terminálnym aminosokovým koncom pro-Si a má hydrofóbny segment (hydrofóbna kotva) na svojom N-terminálnom konci. To vám umožní spájať sa s plazmatickou membránou črevných buniek s okrajom kefy.
Gén, ktorý kóduje tento komplex u ľudí, sa nachádza v dlhom ramene chromozómu 3 a vzhľadom na veľkú homológiu sekvencie medzi oboma podjednotkami (viac ako 40%) sa navrhuje, že tento enzým vznikol prostredníctvom genetickej duplicitnej udalosti udalosť.
Dokázalo sa, že podjednotky, izomaltázy a sacas sú schopné hydrolyzovať.
Štruktúra
Počiatočná forma enzýmu Sacas, pro-Si polypeptid, má približne 260 kDa a 1827 aminokyselín. Proteolytická aktivita pankreatických proteáz však produkuje dve podjednotky 140 kDa a 120 kDa, ktoré predstavujú izomaltázu a sakaras.
Tento enzým je glykoproteín so sacharidovými porciami N- a Ani-Glycosiladas a štúdie ich sekvencie odhaľujú prítomnosť viac ako 19 glykozylačných miest. Časti uhľohydrátov predstavujú viac ako 15% hmotnosti proteínu a sú v podstate zložené z kyseliny sinalovej, galaktozamínu, ruky a N-acetylglukozamínu.
Môže vám slúžiť: leucín: Charakteristiky, štruktúra, funkcie, biosyntézaPretože tieto dve podjednotky komplexu Sacase-Isomaltas nie sú úplne rovnaké, mnohí autori sa domnievajú, že tento enzým je v skutočnosti heterodimérom, kde každá podjednotka pozostáva z glykozylovaného lineárneho polypeptidového reťazca a že je spojená prostredníctvom nekovalentných väzieb.
Izomaltázová podjednotka má hydrofóbny segment 20 aminokyselinových odpadov, ktorý sa podieľa na jeho spojení s membránou enterocytov (črevné bunky) a ktorý predstavuje trvalú kotvu a peptidový signál, ktorý sa má dostať do endoplazmatického retikula.
Aktívne miesto oboch podjednotiek, sacas a izomaltázy, sa nachádza v plazmatickej membráne enterocytov, vyčnievajúce smerom k črevnému lúmenu.
Funkcia
Hlavné metabolické funkcie enzýmov, ako je napríklad nápadník-izomaltáz, súvisia s produkciou glukózy a fruktózy z sacharózy. Monosacharidy, ktoré sa transportujú do črevných buniek a ktoré sú začlenené do rôznych metabolických trás s rôznymi účelmi.
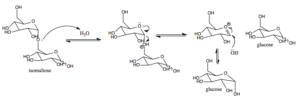 Mechanizmus pôsobenia cukru-izomaltázy u cicavcov (zdroj: AREID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Mechanizmus pôsobenia cukru-izomaltázy u cicavcov (zdroj: AREID3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Glukóza, pre ktorú existujú špecifické transportéry, je možné namietať intracelulárne na glykolýzu, kde jej oxidácia vedie k výrobe energie vo forme ATP a redukcii energie vo forme NADH.
Na druhej strane fruktóza môže byť tiež metabolizovaná sériou reakcií, ktoré začínajú fosforyláciou na fruktózu 1-fosfát a katalyzované pečeňou fruktochinázy. Tým sa začína zahrnutie tohto substrátu do iných trás výroby energie.
Okrem toho, rovnako ako v prípade enzýmu invertovaného v rastlinách, aktivita cukru-izomaltázy má dôležité dôsledky v bunkových aspektoch, ako je osmotický tlak, ktoré zvyčajne podáva fyziologické udalosti, ako je rast, vývoj, transport molekúl a iných.
Choroby súvisiace s človekom
U ľudí známych ako nápadník-Isomaltasa alebo nedostatok CSID (angličtina sa vyskytuje vrodené autozomálne ochorenie (angličtina Vrodená deficitácia lindy-izomaltázy), ktorá súvisí s defektmi v oligo trávení a osmoticky aktívnych disacharidoch.
Môže vám slúžiť: zakladajúci efektToto ochorenie súvisí s niekoľkými súčasnými faktormi, medzi ktorými je nesprávne stíhanie pro-IF prekurzorovej formy enzýmu, genetické mutácie, chyby počas transportu atď.
Tento stav je ťažké diagnostikovať, často sa zamieňajú s intoleranciou laktózy. Preto je známa aj ako „intolerancia sacharózy“.
Vyznačuje sa vývojom brušných kŕčov, hnačiek, zvracania, Jaquecas sprevádzaných hypoglykémiou, nedostatkom rastu a prírastku hmotnosti, úzkosti a nadmernej výroby plynov.
Odkazy
- Brunner, J., Hauser, h., Braun, h., Wilson, K., Wecker, w., O'Neill, b., & Semenza, G. (1979). Spôsob asociácie enzýmového komplexu lygáza-izomaltázu s črevnou hraničnou membránou kefou. The Journal of Biological Chemistry, 254(6), 1821-1828.
- Cowell, G., Tranum-Jensen, J., Sjöström, h., & Norén, alebo. (1986). Topológia a kvartérna štruktúra pro-suka-izomaltázy a konečná forma SIMED / ISOMALTASE. Biochemický časopis, 237, 455-461.
- Hauser, h., & Semenza, G. (1983). Limade-izomaltázy: stopovaný vnútorný proteín hraničnej membrány kefy. Kritické recenzie v Bioch, 14(4), 319-345.
- Hunziker, w., Spiesss, m., Semenza, G., & Lodish, h. F. (1986). Komplex limade-lsomaltázy: primárna štruktúra, orientácia membrány a vývoj stopovaného, vnútorného kefového hraničného proteínu. Bunka, 46, 227-234.
- Naim, h. A., Roth, J., Sterchi, e. A., Lentze, m., Míľa, p., Schmitz, J., & Hauril, h. (1988). Deficitácia lind-izomaltázy u ľudí. J. Klin. Investovať., 82, 667-679.
- Rodriguez, i. R., Taravel, f. R., & Whelan, W. J. (1984). Charakterizácia a funkcia črevnej črevnej linde-izomaltázy a jej samostatných podjednotiek. eur. J. Biochem., 143, 575-582.
- Schiweck, h., Clarke, m., & Pollach, G. (2012). Cukor. V Ullmannova encyklopédia priemyselnej chémie (Zv. 34, P. 72). Wiley-Vch Verlag GmbH & Co. Kgaa.
- Treem, w. (Devätnásť deväťdesiatpäť). Vrodená deficitácia lindy-izomaltázy. Journal of Pediatric Gastroenterology and Výživa, dvadsaťjeden, 1-14.
- « Charakteristiky gastrinu, štruktúra, výroba, funkcie
- 11 hlavných typov inžinierstva a ich vlastnosti »

